A massa atômica, como o próprio nome sugere, é a massa de um átomo, sendo simbolizada geralmente por “ma” ou “MA”. Porém, visto que o átomo é uma entidade extremamente pequena, invisível aos olhos humanos, não é possível medir sua massa por meio de balanças, por exemplo. Assim, os cientistas determinaram a massa dos átomos por meio de comparações com as massas de outros átomos.
Isso é feito com as outras unidades também. Por exemplo, a unidade de massa é o quilograma-padrão, que corresponde a um cilindro de 3,917 cm de altura e de diâmetro, feito de 10% de irídio e 90% de platina. Assim, ele serve de comparação. Por exemplo, se “pesamos” um objeto em uma balança e descobrimos que sua massa é 10 kg, isso significa que sua massa é 10 vezes maior que o padrão escolhido: 1 kg.
O mesmo é aplicado aos átomos. O padrão escolhido foi o carbono-12, sendo que foi atribuída arbitrariamente a esse átomo a massa de 12 u. O “u” é a unidade de massa atômica e equivale, portanto, a 1/12 da massa de um átomo de carbono.
Por exemplo, quando dizemos que a massa atômica do hidrogênio é igual a 1 u, quer dizer que é como se dividíssemos o carbono em 12 partes, sendo que a massa de uma dessas partes é equivalente à massa do átomo de hidrogênio. Outro exemplo é o enxofre, sua massa atômica é 32 u, o que significa que sua massa é 32 vezes maior que 1/12 da massa do 12C.
1 u = 1/12 da massa de 1 átomo de carbono 12
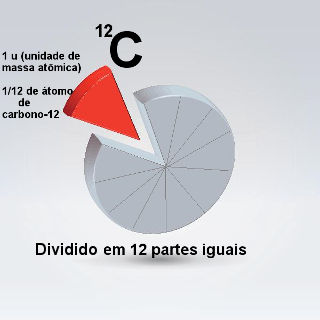
A unidade de massa atômica é 1/12 da massa do carbono-12
A massa molecular das substâncias é a soma das massas atômicas dos elementos. Por exemplo, a massa atômica do oxigênio é igual a 16 u, assim a massa molecular da molécula do gás oxigênio (O2) é igual a 32u.
Visto que atualmente as técnicas laboratoriais estão bem avançadas, existem aparelhos que medem com precisão a massa atômica dos elementos, como o espectrômetro em massa. Assim, é possível saber que 1 u é igual a 1,66054 . 10-24 g.
Tópicos deste artigo
Mapa Mental: Massa Atômica
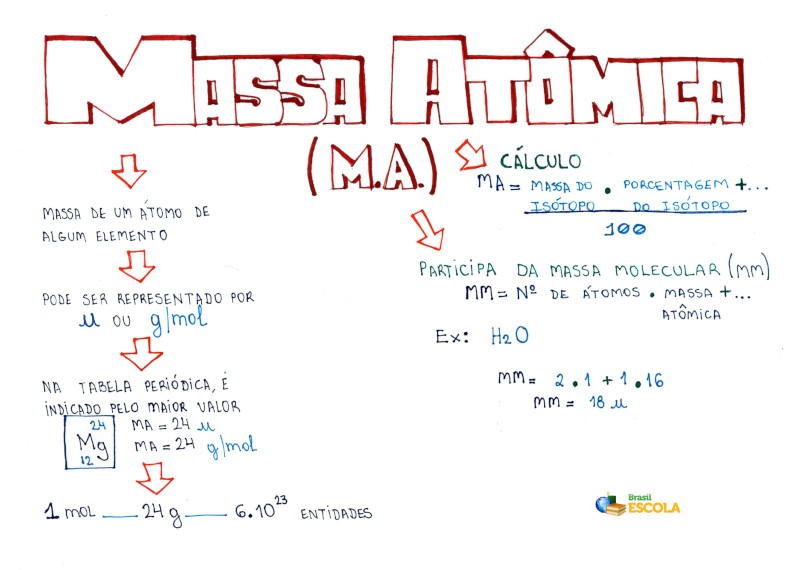
*Baixe o mapa mental sobre massa atômica!
Visto que as massas atômicas são determinadas com grande precisão, elas são dadas na tabela periódica na forma de números decimais. Mas quando vamos fazer os cálculos, geralmente usamos o número arredondado, com exceção de experimentos que precisam ser bem precisos. Por exemplo, se você olhar na Tabela Periódica, verá que a massa atômica do oxigênio é igual a 15,999 u, mas usamos geralmente o valor 16 u nos cálculos. Isso acontece com o carbono também, cuja massa atômica é dada por 12,01 u, como mostrado abaixo:
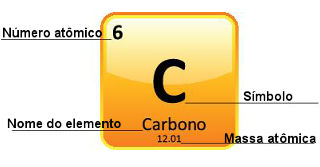
Representação do carbono na Tabela Periódica
Os elementos que aparecem na Tabela Periódica são, na realidade, a média ponderada de todos os isótopos naturais do elemento. Assim, a massa atômica que aparece na Tabela também é a média das massas atômicas desses elementos. Por exemplo, o cloro (C?) possui dois isótopos naturais, o 35 e o 37, cujas porcentagens respectivas na natureza são de 75,76% e 24,24%. As massas atômicas de cada um desses isótopos são diferentes, sendo que a do C?-35 é 34,96885 u e a do C?-37 é 36,96590.
Desse modo, a massa atômica do elemento é calculada levando-se em consideração a massa de cada isótopo e a abundância com que ele aparece na natureza. No caso do cloro, temos:
Massa atômica do elemento cloro = (34,96885 . 75,76%) + (36,96590 . 24,24%)
100%
Massa atômica do elemento cloro = 35,45
Esse é o valor da massa atômica do cloro que aparece na Tabela Periódica.
* Mapa Mental por Me. Diogo Lopes
Por Jennifer Fogaça
Graduada em Letras

