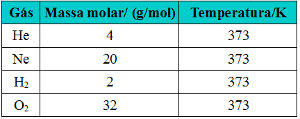
A densidade é uma grandeza que pode ser calculada através da relação entre a massa e o volume do corpo. Isso também se aplica ao caso dos gases:
dgás = mgás
Vgás
A unidade de densidade dos gases costuma ser g/L.
Sabe-se que nas CNTP (Condições Normais de Temperatura e Pressão) 1 mol de qualquer gás sempre ocupa um volume de 22,4 L. Assim, a densidade para gases nessas condições podem ser calculadas pela relação entre a massa molar e esse volume em mols:
dgás = ___M_____
22,4 L . mol-1
Mas essa fórmula só pode ser usada se o gás estiver nas CNTP. Se quisermos calcular a densidade absoluta para qualquer gás, podemos usar outra fórmula que encontramos por meio da equação de estado dos gases:
pV = nRT
Sendo que n = m/M, substituímos “n” na equação de estado dos gases:
pV = mRT
M
m = pM
V RT
Como a densidade é a massa sobre o volume, então temos:
d = pM
RT
Essa equação nos mostra que a densidade absoluta de um gás depende da pressão e da temperatura em que o gás se encontra; isso ocorre não é por causa da massa, pois ela não depende da pressão e da temperatura, mas o volume depende.
Observe que a densidade do gás é inversamente proporcional à sua temperatura. Esse é o princípio que explica como funciona a prática do balonismo: o ar do balão é o ar atmosférico que, quando aquecido, diminui de densidade e, dessa forma, eleva-se ao céu. Quanto mais se aquecer o ar contido no balão, menor será sua densidade e mais o balão subirá.
Veja um exemplo de como utilizar essa fórmula para descobrir a densidade de um gás:
Exemplo: Qual a densidade absoluta do gás oxigênio (O2) a 600 mmHg e 127 ºC? (Massa atômica: O = 16)
Resolução:
Dados:
Massa molar: O2: 2 . 16 = 32 g/mol;
p = 600 mmHg;
R = 62,3 mmHg . L . mol-1 . K-1
T = 127 ºC → 127 + 273 = 400 K
d = PM
RT
d = _600 . 32__
62,3 . 400
d = 0,774 g/L
Visto que nas CNTP a pressão é igual a 1 atm, a temperatura é 273 K e R é igual a 0,082 ou 22,4/273, temos:
d = PM
RT
d = ___1 . M_____
(22,4/273) . 273
d = ___M_____
22,4 L . mol-1
Chegamos novamente à fórmula mencionada anteriormente para os gases nas CNTP. Vejamos um exemplo de como usar essa fórmula:
Exemplo: Qual é a massa molecular de um gás cuja densidade absoluta nas CNTP é de 1,96 g/L?
Resolução:
d = ___M_____
22,4 L . mol-1
M = 22,4 . d
M = (22,4 L/mol) . (1,96 g/L)
M = 43,90 g/mol
Por Jennifer Fogaça
Graduada em Química