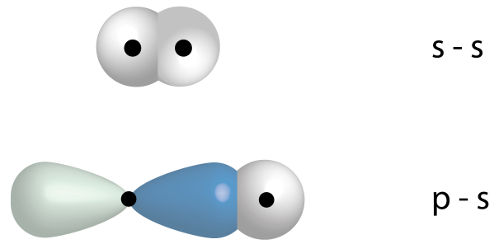
Para classificar uma ligação sigma, é fundamental saber reconhecê-la na estrutura de uma molécula. A ligação sigma é, na verdade, uma ligação covalente que ocorre quando dois orbitais atômicos incompletos (com apenas um elétron) interpenetram-se no mesmo eixo. Um exemplo é quando um orbital do tipo p (hélice) interpenetra-se a outro orbital p.

Orbitais p interpenetrando-se em uma ligação sigma p-p
Na prática (nos exercícios), o reconhecimento e a classificação de uma ligação sigma são feitos a partir da fórmula estrutural de uma substância, como na representação estrutural abaixo:
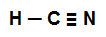
Fórmula estrutural do ácido cianídrico
Antes de classificar uma ligação sigma, é necessário saber reconhecê-la em uma fórmula estrutural. Para isso, basta lembrar as formas como uma ligação covalente é representada: a ligação simples é representada por um traço apenas (-), a dupla é representada por dois (=) e a ligação tripla é representada por três (≡). A ligação sigma está presente em qualquer uma das três representações de ligações covalentes da seguinte forma:
-
Simples: possui uma ligação sigma;
-
Dupla: Das duas ligações, apenas uma é sigma;
Não pare agora... Tem mais depois da publicidade ;) -
Tripla: Um das três ligações é sigma.
Sabendo reconhecer uma ligação sigma, o próximo passo é aprender a realizar sua classificação. Para isso, devemos saber qual é o orbital incompleto de cada átomo envolvido na ligação:
-
H - apresenta o orbital s incompleto, assim, na classificação, é representado por s.
-
Ametais- apresentam orbital p incompleto, assim, na classificação, são representados por p, com exceção dos seguinte elementos:
-
Carbono: Seu orbital incompleto depende do tipo de hibridização que ele sofre. As possibilidades são: hibridização sp3 (quanto realiza quatro ligações simples), sp2 (quanto realiza duas ligações simples e uma dupla) ou sp (quanto realiza duas ligações duplas ou uma simples e uma tripla). Assim, na classificação de uma ligação sigma, o Carbono pode ser representado por sp3, sp2 ou sp dependendo da ligação que estiver fazendo.
-
Berílio: sofre hibridização do tipo sp, assim, na classificação, é representado por sp.
Não pare agora... Tem mais depois da publicidade ;) -
Boro: sofre hibridização do tipo sp2, assim, na classificação, é representado por sp2.
Com todas essas informações, a parte mais fácil é classificar as ligações sigmas presentes em uma estrutura. Vamos ver alguns exemplos:
Exemplo 1: Ligações sigmas na água
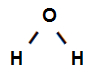
Fórmula estrutural da água
A fórmula estrutural acima mostra que a água apresenta duas ligações sigmas (duas simples), estando elas entre o Oxigênio (representado por p) e o Hidrogênio (representado por s). Assim, temos duas ligações sigmas classificadas em:
s-p
Exemplo 2: Ligações sigmas no Tricloreto de fósforo
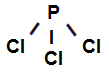
Fórmula estrutural do Tricloreto de fósforo
A fórmula estrutural acima mostra que o tricloreto de fósforo apresenta três ligações sigmas (três simples), estando elas entre o Fósforo (representado por p) e o Cloro (representado por p). Assim, temos três ligações sigmas classificadas em:
p-p
Exemplo 3: Ligações sigmas no trifluoreto de boro
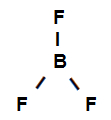
Fórmula estrutural do trifluoreto de boro
A fórmula estrutural acima mostra que o trifluoreto de boro apresenta três ligações sigmas (três simples), estando elas entre o Boro (representado por sp2) e o Flúor (representado por p). Assim, temos três ligações sigmas classificadas em:
p-sp2
Exemplo 4: Ligações sigmas no etanol
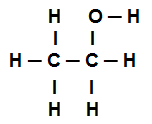
Fórmula estrutural do etanol
A fórmula estrutural do etanol acima mostra que temos a presença de oito ligações sigmas (oito ligações simples). São elas:
-
Uma entre o Oxigênio (representado por p) e o Hidrogênio (representado por s). Assim, a ligação é classificada em sigma s-p.
Não pare agora... Tem mais depois da publicidade ;) -
Uma entre dois carbonos que realizam apenas ligações sigmas (sendo então representados por sp3). Assim, a ligação é classificada em sp3-p3.
-
Uma entre o Carbono (representado por sp3) e o Oxigênio (representado por p). Assim, a ligação sigma é classificada em p-sp3.
-
Cinco entre o carbono (representado por sp3) e o Hidrogênio (representado por s). Assim, todas as cinco são classificadas em s-sp3.
Exemplo 5: Ligações sigmas no Dicloroeteno
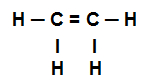
Fórmula estrutural do Dicloroeteno
A fórmula estrutural do Dicloroeteno acima mostra que temos a presença de cinco ligações sigmas (as quatro ligações simples e uma das ligações da dupla). São elas:
-
Uma entre dois carbonos que realizam duas ligações simples e uma dupla (sendo então representados por sp2). Assim, a ligação sigma é classificada em sp2-p2.
-
Quatro estão entre o carbono (representado por sp2) e o Hidrogênio (representado por s). Assim, todas as quatro são classificadas em s-sp2.
Por Me. Diogo Lopes Dias