A transformação adiabática é uma transformação termodinâmica em que há compressão e expansão muito rápida do gás, o que impede que haja transferências de calor e de matéria entre o recipiente isolado e o ambiente externo. Ela também pode acontecer quando as temperaturas entre o sistema do gás e o ambiente externo são as mesmas, não havendo troca de calor entre eles.
Leia também: Gases — o estudo em torno desse estado da matéria
Tópicos deste artigo
- 1 - Resumo sobre transformação adiabática
- 2 - Mapa mental sobre transformação adiabática
- 3 - O que é transformação adiabática?
- 4 - Exemplos de transformação adiabática
- 5 - Primeira lei da Termodinâmica e a transformação adiabática
- 6 - Compressão e expansão adiabática
- 7 - Fórmulas da transformação adiabática
- 8 - Exemplos de cálculos envolvendo transformação adiabática
- 9 - Gráfico da transformação adiabática
- 10 - Diferenças entre transformação adiabática e transformação isotérmica
- 11 - Exercícios resolvidos sobre transformação adiabática
Resumo sobre transformação adiabática
-
Na transformação adiabática, à medida que diminuímos a energia interna do sistema, há a realização de trabalho.
-
Há transformação adiabática no ciclo de Brayton, no ciclo de Carnot e no ciclo de Otto.
-
A energia interna do sistema é proporcional à temperatura do gás, mas inversamente proporcional ao volume do gás.
-
O gás pode ser comprimido ou expandido adiabaticamente.
-
Na expansão adiabática, há crescimento do volume e queda da temperatura e da pressão do gás.
Não pare agora... Tem mais depois da publicidade ;) -
O gráfico da transformação adiabática gera hiperbóles que interceptam isotermas.
Mapa mental sobre transformação adiabática
* Baixe o mapa mental sobre transformação adiabática!
O que é transformação adiabática?
A transformação adiabática é um processo termodinâmico que não permite que ocorram trocas de calor (energia térmica) e de matéria entre um recipiente térmico isolado composto por um gás com o meio externo, devido à compressão ou expansão rápida sofrida pelo gás. Por isso, deu-se a nomenclatura adiabático(a), que advém do grego adiabatos, que significa intransponível, impenetrável.
Além disso, ela também pode ocorrer quando o repiente e o ambiente externo apresentam a mesma temperatura, estando em equilíbrio térmico, não ocorrendo a transferência de calor entre eles.
Exemplos de transformação adiabática
Alguns exemplos da transformação adiabática são os aerossóis e sprays, compostos por gases pressurizados que quando acionada a válvula são expelidos a altas velocidades, impedindo a transmissão de calor entre o gás e o ambiente.
Além disso, a transformação adiabática tem papel importante na participação de alguns ciclos:
-
Ciclo de Brayton: ciclo que trata do funcionamento das turbinas a gás.
-
Ciclo de Carnot: ciclo que trata do funcionamento das máquinas térmicas, como as turbinas a vapor e a querosene dos aviões a jato, os motores de combustão e os reatores termonucleares.
-
Ciclo de Otto: ciclo que trata do funcionamento dos motores a gasolina.
Primeira lei da Termodinâmica e a transformação adiabática
A primeira lei da Termodinâmica aborda a variação da energia interna relacionada ao trabalho e ao calor. Contudo, nas transformações adiabáticas, o gás não ganha nem perde calor para/do meio externo, por isso consideramos o calor como nulo, ocasionando a conversão completa de energia interna do sistema em trabalho.
Com o aumento de volume do gás, há a diminuição da energia interna do sistema e, consequentemente, a diminuição da temperatura e a realização de trabalho.
Compressão e expansão adiabática
Nas transformações adiabáticas, os gases podem sofrer expansão ou compressão, como descreveremos a seguir.
-
Compressão adiabática
Na compressão adiabática, o gás é comprimido adiabaticamente por um trabalho externo que ocasiona um aumento da sua energia interna, de modo que o seu pistão se move para baixo, como podemos ver na imagem abaixo:
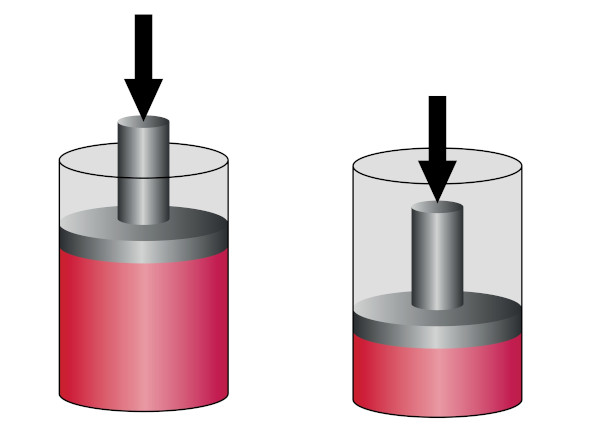
Com isso, ela é caracterizada pela diminuição de volume do gás, ocasionando um aumento da sua temperatura e da sua pressão, ainda que não ocorram perdas de calor entre o gás e a vizinhança. Em razão disso, ela é usada com o objetivo de aquecer os gases, como no caso das bombas de ar de encher pneus.
-
Expansão adiabática
Na expansão adiabática, o gás se dilata adiabaticamente, movendo o pistão para cima. Com isso, ele realizará um trabalho externo utilizando sua energia interna. Assim, há um aumento do trabalho à medida que há diminuição da sua energia interna, como podemos ver na imagem abaixo:
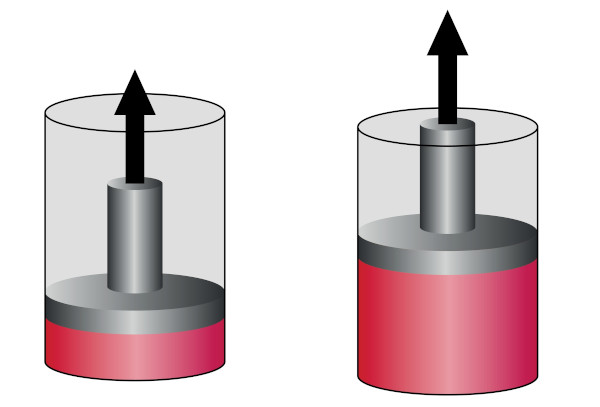
Dessa forma, ela é caracterizada pelo aumento de volume do gás, ocasionando uma diminuição da sua temperatura e da sua pressão, ainda que não ocorram perdas de calor entre o gás e a vizinhança. Em razão disso, ela é usada com o objetivo de resfriar os gases, como no caso dos desodorantes em spray.
Leia também: Terceira lei da Termodinâmica — a lei que fala sobre o zero absoluto
Fórmulas da transformação adiabática
-
Equação de Poisson
\(p_o∙V_o^γ=p∙V^γ\)
-
-
\(p_o\) é a pressão inicial, medida em Pascal \( \).
-
\(v_o\) é o volume inicial, medido em metros cúbicos \([m^3] \) ou litros \( \).
-
\(γ\) é o expoente de Poisson, também chamado de coeficiente de expansão adiabática.
-
p é a pressão final, medida em Pascal \( \).
-
V é o volume final, medido em metros cúbicos \([m^3] \) ou litros \( \).
Não pare agora... Tem mais depois da publicidade ;)
-
Observação: Na maioria dos exercícios de transformação adiabática, precisamos converter as unidades de medida da pressão e do volume. Quanto à pressão, basta multiplicarmos o valor dado em atm por \(1,01\cdot10^5\ Pa\) — por exemplo, \(2\ atm \) são \(2,02\cdot10^5 \ Pa\). Quanto ao volume, dividimos o valor dado em litros por mil, já que 1 litro é \(0,001\ m^3\).
-
Expoente de Poisson
\(γ=\frac{C_p}{C_v} \)
-
-
\(γ\) é o expoente de Poisson. Ele depende da atomicidade do gás.
-
\(C_p\) é a capacidade térmica a pressão constante.
-
\(C_v\) é a capacidade térmica a volume constante.
-
-
Transformação adiabática e a primeira lei da Termodinâmica
\(∆U=-W\)
-
\(∆U\) é a variação da energia interna, medida em Joule \( \).
-
W é o trabalho do gás, medido em Joule \( \).
Exemplos de cálculos envolvendo transformação adiabática
Exemplo 1: Qual a pressão inicial de um gás com volume de 5 litros que se comprime adiabaticamente até um volume de 3 litros a uma pressão final de 4 atm? Considere que capacidade térmica a pressão constante é 7 e a capacidade térmica a volume constante é 5.
Primeiramente, calcularemos o expoente de Poisson por meio da fórmula:
\(γ=\frac{C_p}{C_v} \)
\(γ=\frac{7}5\)
\(γ=1,4\)
Então, o expoente de Poisson é 1,4. Posteriormente, vamos calcular a pressão inicial do gás utilizando a fórmula:
\(p_o\cdot V_o^γ=p\cdot V^γ\)
\(p_o\cdot 5^{1,4}=4\cdot 3^{1,4}\)
\(p_o\cdot9,51=4\cdot 4,65\)
\(p_o\cdot9,51=18,62\)
\(p_o=\frac{18,62}{9,51}\)
\(p_o≅1,95\ atm\)
A pressão inicial desse gás é de aproximadamente 1,95 atm.
Exemplo 2: Qual a variação de energia interna de um gás que se comprime adiabaticamente com um trabalho de 50 Joules?
Calcularemos a variação da energia interna de um gás adiabático usando a fórmula:
\(∆U=-W\)
Como o gás está comprimindo, seu trabalho é negativo:
\(∆U=-(-50) \)
\(∆U=50\ J\)
Então, a variação de energia interna desse gás é de 50 Joules.
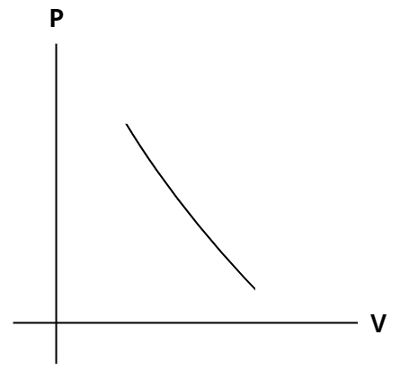
Gráfico da transformação adiabática
O gráfico da transformação adiabática corresponde a um diagrama da pressão pelo volume, representado por meio de uma hipérbole (curva verde) que corta as curvas isotermas (curvas cinzas), que são curvas obtidas pelo gráfico da pressão pelo volume em transformações isotérmicas, sendo que a temperatura é constante pelo fato de o coeficiente de Poisson ser maior que um, como podemos ver no gráfico abaixo:
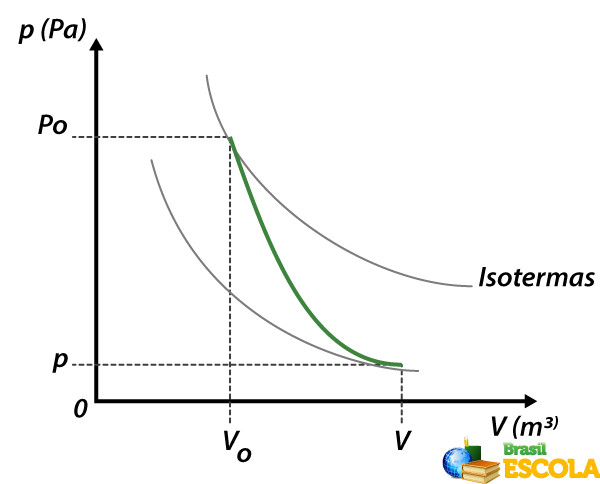
A área que está abaixo da função da transformação adiabática equivale ao trabalho do processo termodinâmico.
Diferenças entre transformação adiabática e transformação isotérmica
A transformação adiabática e a transformação isotérmica são processos termodinâmicos completamente distintos. Na transformação adiabática não há variação de calor, mas há variação de pressão, volume e temperatura, diferentemente da transformação isotérmica, em que a temperatura se mantém inalterada e ocorre a variação de pressão e volume.
Leia também: Como calcular o rendimento das máquinas térmicas
Exercícios resolvidos sobre transformação adiabática
Questão 1
Qual a pressão final aproximada de um gás com volume de 4 litros que se expande adiabaticamente até um volume de 6 litros, sabendo que sua pressão inicial era de 5 atm e o coeficiente de Poisson γ vale 3?
a) 5,72
b) 4,35
c) 3,89
d) 2,64
e) 1,48
Resolução:
Alternativa E
Calcularemos a pressão final por meio da equação de Poisson para uma transformação adiabática:
\(p_o\cdot V_o^γ=p\cdot V^γ\)
\(5\cdot4^3=p\cdot6^3\)
\(5\cdot64=p\cdot216\)
\(320=p\cdot216\)
\(p=\frac{320}{216}\)
\(p=1,48\)
Questão 2
(Ufam-AM) Analise as seguintes afirmativas a respeito dos tipos de transformações ou mudanças de estado de um gás.
I – Em uma transformação isocórica, o volume do gás permanece constante.
II – Em uma transformação isobárica, a pressão do gás permanece constante.
III – Em uma transformação isotérmica, a temperatura do gás permanece constante.
IV – Em uma transformação adiabática, variam o volume, a pressão e a temperatura.
Com a relação às quatro afirmativas acima, podemos dizer que:
a) só I e III são verdadeiras.
b) só II e III são verdadeiras.
c) I, II, III e IV são verdadeiras.
d) só I é verdadeira.
e) todas são falsas.
Resolução:
Alternativa C
Todas as alterantivas apresentam as definições corretas das transformações termodinâmicas.
Por Pâmella Raphaella Melo
Professora de Física