Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) foi um químico italiano que estabeleceu pela primeira vez a ideia de que uma amostra de um elemento, com massa em gramas numericamente igual à sua massa atômica, apresenta sempre o mesmo número de átomos (N).
O próprio Avogadro não conseguiu determinar o valor de N. Porém, ao longo do século XX, o avanço da tecnologia e do conhecimento científico possibilitou que outros cientistas desenvolvessem técnicas para determiná-lo. Quando finalmente esse valor foi descoberto, foi denominado de constante de Avogadro, em homenagem a este cientista, pois foi ele que estabeleceu os fundamentos para a sua criação.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
Em 1 mol de qualquer entidade (átomos, moléculas, elétrons, fórmulas ou íons) está contido exatamente o valor da constante de Avogadro.
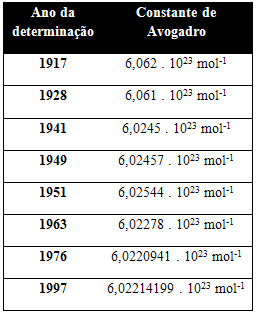
A tabela abaixo mostra alguns valores para a constante de Avogadro obtidos ao longo do século XX:
Veja algumas das técnicas usadas para tentar determinar o valor da constante de Avogadro:
O primeiro cientista a fazer um cálculo aproximado para a constante de Avogadro foi Johann Joseph Loschmidt. No ano de 1867, ele se baseou na teoria cinética dos gases e determinou quantas moléculas existiam em 1 cm3 de um gás.
Outro destes cientistas foi o francês Jean Baptiste Perrin (1870-1942) que contou o número de partículas coloidais por unidade de volume em uma suspensão e mediu suas massas. O valor que ele encontrou ficou entre 6,5 e 7,2 . 1023 entidades por mol. Esse cientista publicou, em 1913, o livro Les Atomes (1ª ed. Paris: Alcan), sendo que sua 9ª edição, publicada em 1924, continha 16 maneiras de se obter experimentalmente a constante de Avogadro.

Jean Baptiste Perrin (1870-1942)
Anos mais tarde, o cientista James Dewar (1842-1923) utilizou um método desenvolvido anos antes pelo radioquímico Bertram Boltwood (1870-1927) e pelo físico Ernest Rutherford (1871-1937), que basicamente consistia na contagem das partículas alfa emitidas por uma fonte radioativa e na determinação do volume do gás hélio obtido. O valor encontrado por Dewar foi de 6,04 . 1023 mol-1.
Ainda no século XX, Robert Millikan (1868-1953) realizou um experimento para determinar a carga do elétron (1,6 . 10-19 C). Como a carga de 1 mol de elétrons já era conhecida (96500 C), foi possível relacionar esses dois valores e descobrir o seguinte valor para a constante de Avogadro: 6,03 . 1023 mol-1.
Atualmente, o valor recomendado para a constante de Avogadro é de 6,02214 x 1023 mol-1 e é determinado por meio da difração de raios X, em que se obtém o volume de alguns átomos de um retículo cristalino, desde que se conheça a densidade e a massa de 1 mol de átomos da amostra.
Para efeito didático, no Ensino Médio, em que os cálculos não precisam ser tão precisos quanto os realizados em laboratórios químicos, considera-se a constante de Avogadro como 6,02 . 1023 mol-1.
Existem também métodos mais simples que podem ser usados para ajudar os alunos a determinarem a constante de Avogadro na prática. Um deles é por meio da eletrólise em meio aquoso.
Por Jennifer Fogaça
Graduada em Química

