Nos laboratórios e indústrias químicas é muito importante conhecer a quantidade de substâncias envolvidas nas reações. Por isso, a seguir trataremos dos principais conceitos, grandezas e unidades de medida relacionadas às massas dos átomos:
- Unidade de Massa Atômica (u):
O átomo padrão de referência de pesagem para designar a unidade de massa atômica é o carbono-12 (12C). Uma unidade de massa atômica (1 u) corresponde ao valor de 1,66054 . 10-24 g, que é a massa de 1/12 do isótopo do carbono com massa igual a 12 (12C).
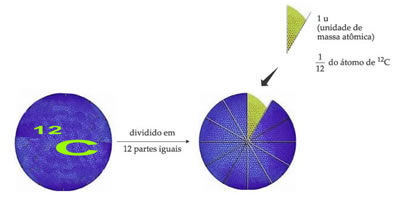
A unidade de massa atômica (u) é a unidade usada em todas as grandezas relacionadas a seguir.
- Massa Atômica de um Átomo ou Isótopo (MA):
É obtida por meio da comparação com o valor de referência citado no item anterior. Por exemplo, a massa atômica do 919F é dada pelo espectrômetro de massas, que é igual a 18,9984 u. Arredondando, é igual a 19, que é o mesmo valor do número de massa (A) dele. Esse valor significa que a massa atômica do elemento 919F é 19 vezes maior que a massa de 1/12 do 12C.
- Massa Atômica de um Elemento (MA):
A massa atômica do elemento é determinada pela média ponderada das massas atômicas dos seus isótopos. Isso é feito multiplicando-se as massas atômicas de cada isótopo pela porcentagem que aparece na constituição do elemento. Depois, somam-se esses valores, que são divididos por 100, resultando na porcentagem total.
Por exemplo, o elemento neônio é composto de três isótopos com as seguintes massas atômicas e porcentagens em sua constituição:
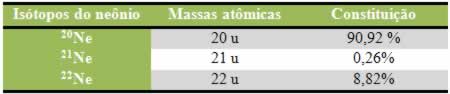
Calculando a massa atômica (MA) desse elemento:
MAneônio = (20 . 90,92) + (21 . 0,26) + (22 . 8,82)
100
MAneônio = 20,179 u
- Massa Molecular (MM):
Como o próprio nome diz, é usada para substâncias moleculares, ou seja, átomos ligados através de um compartilhamento de pares de elétrons, que são as denominadas ligações covalentes.
A massa molecular é conseguida multiplicando-se a quantidade de átomos de cada elemento pelas suas massas atômicas e somando-se os resultados.
Por exemplo, a molécula de CO2 contém um carbono e dois oxigênios, assim multiplicaremos a massa atômica do carbono por 1; e a do oxigênio por dois, somando-as posteriormente:
MMCO2 = (1 . MAC) + (2 . MAO)
MMCO2 = (1 . 12) + (2 . 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Massa–Fórmula:
É o mesmo cálculo realizado para a massa molecular, porém, para compostos iônicos. Nesse caso o nome é diferente, porque eles não estão agrupados em moléculas, mas em aglomerados de íons. Como não existem as moléculas, evidentemente não há sentido em falar em massa molecular, porém o raciocínio do cálculo é o mesmo.
Exemplo:
NaCl
↓ ↓
23 +35,5 → Massa-fórmula = 58,5 u
Por Jennifer Fogaça
Graduada em Química



