O gadolínio é um elemento químico pertencente à série dos lantanídeos, caracterizado por seu brilho metálico branco-prateado e por se apresentar no estado sólido em temperatura ambiente. Além disso, esse metal é encontrado principalmente em minerais como monazita e bastnasita, dos quais é extraído por meio de processos de separação e refino. Embora seja relativamente estável ao ar seco, ele oxida rapidamente quando exposto à umidade, formando uma camada de óxido que protege o metal subjacente de oxidação adicional, ou seja, pode ser usado como metal de sacrifício.
Leia também: Ítrio — metal amplamente utilizado em telas de televisores antigos e modernos
Tópicos deste artigo
- 1 - Resumo sobre gadolínio
- 2 - Propriedades do gadolínio
- 3 - Características do gadolínio
- 4 - Onde o gadolínio é encontrado?
- 5 - Obtenção do gadolínio
- 6 - Ocorrência do gadolínio
- 7 - Aplicações do gadolínio
- 8 - Precauções com o uso do gadolínio
- 9 - Curiosidades sobre o gadolínio
- 10 - História do gadolínio
Resumo sobre gadolínio
-
Gadolínio é um elemento metálico da série dos lantanídeos e de número atômico 64.
-
É um agente de contraste em ressonância magnética e tem potencial uso em terapias contra câncer.
-
É usado na fabricação de materiais magnéticos e adicionado em ligas metálicas.
-
Faz parte de barras de controle em reatores nucleares e componentes eletrônicos como capacitores.
-
Proporciona melhoria de propriedades ópticas e térmicas de vidros e cerâmicas.
Não pare agora... Tem mais depois da publicidade ;) -
Possui propriedades magnetocalóricas.
-
Sua produção é limitada devido a sua baixa concentração em minerais.
-
Seu nome deriva do mineral gadolinita, homenageando Johan Gadolin.
-
Seu manuseio deve ser feito com equipamentos de proteção.
-
É necessário evitar a ingestão acidental, bem como armazená-lo em local seco e ventilado.
-
Foi descoberto em 1880 por Jean Charles Galissard de Marignac.
Não pare agora... Tem mais depois da publicidade ;) -
Sua obtenção em sua forma pura foi realizada por Paul-Émile Lecoq de Boisbaudran em 1886.
Propriedades do gadolínio
-
Símbolo: Gd.
-
Massa atômica: 157,25 u.
-
Número atômico: 64.
-
Configuração eletrônica: 4f7 5d1 6s2.
-
Eletronegatividade: 1,20 (na escala Pauling).
Não pare agora... Tem mais depois da publicidade ;) -
Série química: lantanídeos (terras raras).
-
Ponto de fusão: 1312°C.
-
Ponto de ebulição: 3273°C.
-
Energia de ionização: 593,4 kJ/mol (primeira ionização).
-
Densidade: 7,90 g/cm³ (no estado sólido).
-
Estado de oxidação: +3.
Não pare agora... Tem mais depois da publicidade ;) -
Raio atômico (Van der Waals): 180 pm.
Características do gadolínio
As características do gadolínio são típicas de um metal. Por exemplo, ele apresenta um aspecto branco-prateado com brilho metálico, ou pode ficar incolor em solução aquosa. Ademais, também é sólido nas condições normais de temperatura e pressão, e possui reatividade moderada, isto é, ele pode reagir com ácidos liberando hidrogênio ou oxidar rapidamente na presença de umidade. A seguir, veja a imagem com a representação desse metal em sua forma pura.

Onde o gadolínio é encontrado?
O gadolínio é encontrado principalmente em minerais como monazita e bastnasita, sendo o primeiro um fosfato que contém gadolínio junto com outros lantanídeos, enquanto o segundo é um fluocarbonato que também é uma fonte importante desse elemento. Ou seja, são suas principais fontes, justamente por serem ricos em terras raras.
Nesse contento, eles podem ser extraídos de depósitos geológicos localizados em diversas partes do mundo, incluindo a China, Estados Unidos, Índia e Brasil. Vale ressaltar que embora em menor quantidade, o gadolínio também pode ser encontrado em outros minerais dessa natureza.
Veja também: Hidrogênio — o elemento químico mais abundante do Universo
Obtenção do gadolínio
O processo de obtenção do gadolínio envolve várias etapas de extração e refino de minerais como a monazita e a bastnasita. A seguir, falaremos um pouco cada uma delas:
-
Mineração: primeiramente, os minerais monazita e bastnasita são extraídos da terra por meio de mineração.
-
Trituração e moagem: em seguida, passam por um processo de trituração e moagem para reduzir o tamanho das partículas.
-
Tratamento químico: após a moagem, os minerais são submetidos a um tratamento químico, geralmente com ácidos, para separar as terras raras dos outros componentes minerais. Esse tratamento resulta em uma mistura de cloretos ou nitratos de terras raras.
-
Separação: a separação do gadolínio dos outros elementos é realizada por meio de técnicas como extração por solventes ou cromatografia de troca iônica, que aproveitam as ligeiras diferenças nas propriedades químicas dos elementos da mistura.
-
Conversão a óxido: uma vez isolado, o gadolínio em forma de sal é convertido em óxido de gadolínio (Gd2O3).
-
Redução térmica: em seguida ele é reduzido a metal puro por meio de um processo de redução térmica, geralmente utilizando cálcio ou lantânio como agentes redutores em um ambiente controlado, frequentemente dentro de um forno a alta temperatura.
Não pare agora... Tem mais depois da publicidade ;) -
Purificação: por fim, temos a obtenção de gadolínio metálico de alta pureza para aplicações industriais e tecnológicas.
Ocorrência do gadolínio
O gadolínio não ocorre de forma livre na natureza, pois, como já explicado em tópicos anteriores, ele está presente em grandes quantidades em minerais como a monazita e bastnasita, e também, em menores concentrações, em outros tipos, como o xenotímio, sendo este último um fosfato de ítrio que pode conter gadolínio.

Além desses minerais, esse metal é encontrado em depósitos geológicos, como pláceres, que são depósitos sedimentares onde minerais pesados se concentram, e em depósitos primários, localizados em rochas ígneas e metamórficas.
Aplicações do gadolínio
Devido às suas propriedades magnéticas, o gadolínio é amplamente utilizado em diversas aplicações tecnológicas, incluindo ressonância magnética e em ligas para melhorar as características de outros metais. Diante disso, a seguir, destacamos alguns exemplos do seu uso:
-
Gadolínio em ressonância magnética (RM): ele é usado como agente de contraste devido à sua capacidade de alterar o sinal de imagem, melhorando a visualização de tecidos e órgãos conforme a imagem abaixo.
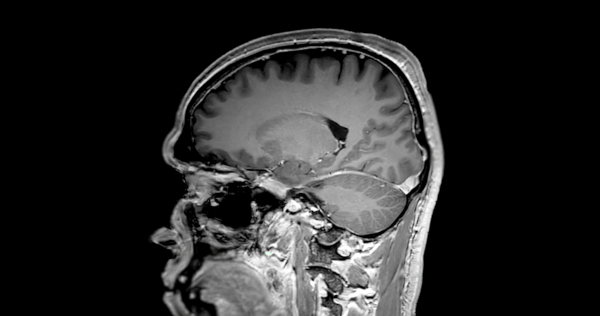
- Gadolínio em materiais magnéticos: ele é incorporado em compostos magnéticos para criar materiais com propriedades magnéticas específicas, úteis em aplicações como ímãs de alta tecnologia.
-
Gadolínio em ligas metálicas: adicionado em pequenas quantidades, o gadolínio pode melhorar a resistência à oxidação e as propriedades mecânicas de ligas de metais como o ferro e o cromo.
Não pare agora... Tem mais depois da publicidade ;) -
Gadolínio em tecnologia nuclear: é utilizado em barras de controle de reatores nucleares, onde sua capacidade de absorver nêutrons ajuda a regular a taxa de reação nuclear.
-
Gadolínio na indústria eletrônica: presente em componentes eletrônicos como capacitores, ele é usado por suas propriedades magnéticas e elétricas.
-
Gadolínio em tratamento de tumores: em terapias com nêutrons, o gadolínio pode ser incorporado em compostos que se acumulam em tumores, permitindo um tratamento mais direcionado e eficaz.
-
Gadolínio na produção de vidros e cerâmicas: pode ser utilizado para melhorar as propriedades ópticas e térmicas de vidros e cerâmicas especiais, como os usados em janelas de fornos e aparelhos ópticos.
Precauções com o uso do gadolínio
O gadolínio, assim como toda substância estranha ao nosso organismo, requer precauções a serem tomadas quanto ao seu manuseio:
-
Deve-se manuseá-lo com cuidado, utilizando equipamentos de proteção adequados, como luvas e óculos de segurança, bem como armazená-lo em local seco e bem ventilado, longe de substâncias incompatíveis que possam causar reações perigosas.
Não pare agora... Tem mais depois da publicidade ;) -
O gadolínio e seus compostos devem ser descartados de acordo com as regulamentações locais e ambientais, pois a sua liberação no meio ambiente pode causar impactos negativos à fauna e flora.
-
Pessoas que trabalham com esse metal devem receber treinamento adequado sobre os riscos associados e as medidas de segurança a serem tomadas, bem como ter sua exposição monitorada regularmente para garantir que esteja dentro dos limites seguros.
-
Deve-se evitar a ingestão acidental, pois pode causar danos à saúde.
Saiba mais: Bário — metal extremamente tóxico usado em contrastes para exames radiológicos
Curiosidades sobre o gadolínio
-
Esse metal tem uma propriedade única chamada de magnetocalórica, o que significa que ele pode mudar de temperatura em resposta a um campo magnético. Isso o torna útil em tecnologias de refrigeração magnética.
-
O nome "gadolínio" é derivado do mineral gadolinita, do qual o elemento foi originalmente isolado. O mineral, por sua vez, foi nomeado em homenagem ao químico Johan Gadolin.
Não pare agora... Tem mais depois da publicidade ;)
História do gadolínio
A história do gadolínio remonta ao século XVIII, quando foi descoberto como um elemento químico. Tal fato está intimamente ligado à descoberta dos "óxidos de terras raras", um grupo de elementos que compartilham propriedades químicas semelhantes e que eram difíceis de separar um do outro na época. Nesse sentido, esse metal foi descoberto em 1880 pelo químico suíço Jean Charles Galissard de Marignac, o qual o isolou por meio da gadolinita, um mineral encontrado na Escandinávia.
O nome "gadolínio" foi dado em homenagem Johan Gadolin, químico finlandês que descobriu a primeira "terra rara", o ítrio, em 1794. No entanto, esse elemento só foi obtido em sua forma metálica pura muitos anos depois, em 1886, pelo químico francês Paul-Émile Lecoq de Boisbaudran, o qual conseguiu isolá-lo por meio de um processo de eletrólise de seus sais em fusão. Desde então, ele tem sido utilizado em diversas aplicações, seja como agente de contraste em ressonância magnética, ou na fabricação de materiais magnéticos e em outras tecnologias.
Fontes
BRÜNJES, R.; HOFMANN, T. Anthropogenic gadolinium in freshwater and drinking water systems. Water Research, [s. l.], v. 182, p. 115966, 2020. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0043135420305030.
GADOLINIUM Gd (Element). PubChem. Disponível em: https://pubchem.ncbi.nlm.nih.gov/element/64#section=Information-Sources
GUO, B. J.; YANG, Z. L.; ZHANG, L. J. Gadolinium Deposition in Brain: Current Scientific Evidence and Future Perspectives. Frontiers in Molecular Neuroscience, [s. l.], v. 11, 2018. Disponível em: https://www.frontiersin.org/article/10.3389/fnmol.2018.00335/full.
IYAD, N. et al. Gadolinium contrast agents- challenges and opportunities of a multidisciplinary approach: Literature review. European Journal of Radiology Open, [s. l.], v. 11, p. 100503, 2023. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S2352047723000291.
KANDA, T. et al. Brain gadolinium deposition after administration of gadolinium-based contrast agents. Japanese Journal of Radiology, [s. l.], v. 34, n. 1, p. 3–9, 2016. Disponível em: http://link.springer.com/10.1007/s11604-015-0503-5.
LEITE, C. da C. Gadolínio e fibrose nefrogênica sistêmica: o que todo médico deve saber. Radiologia Brasileira, [s. l.], v. 40, n. 4, p. IV–V, 2007.
MALLIO, C. A. et al. Exposure to gadolinium and neurotoxicity: current status of preclinical and clinical studies. Neuroradiology, [s. l.], v. 62, n. 8, p. 925–934, 2020. Disponível em: https://link.springer.com/10.1007/s00234-020-02434-8.
VAN DER MOLEN, A. J. et al. Ten years of gadolinium retention and deposition: ESMRMB-GREC looks backward and forward. European Radiology, [s. l.], v. 34, n. 1, p. 600–611, 2023. Disponível em: https://link.springer.com/10.1007/s00330-023-10281-3.
WELLER, M. et al. A química dos lantanídeos. In: Química Inorgânica. 6. ed. Porto Alegre: Bookman, 2017. p. 628–642.

