A variação de entalpia (\(\Delta H\)) é o calor transferido em uma reação química sob pressão constante, que pode ser absorvido, caracterizando um processo endotérmico, ou liberado, caracterizando um processo exotérmico.
O \(\Delta H\), também chamado de entalpia de reação, é caracterizado como função de estado, pois a variação de calor a pressão constante depende apenas das energias dos reagentes (estado inicial) e dos produtos (estado final) em uma reação química. Dessa forma, a variação de entalpia é definida pela diferença entre as entalpias dos produtos e as entalpias dos reagentes.
Leia também: Diferença entre reações endotérmicas e exotérmicas
Tópicos deste artigo
- 1 - Resumo sobre a variação de entalpia
- 2 - Fórmula da variação de entalpia
- 3 - Como calcular variação de entalpia?
- 4 - Variação de entalpia positiva e negativa
- 5 - Exercícios sobre variação de entalpia
Resumo sobre a variação de entalpia
- A variação de entalpia (\(\Delta H\)) é definida pela diferença entre as entalpias dos produtos e as entalpias dos reagentes (\(\Delta H = H_{\text{produtos}} - H_{\text{reagentes}} \)).
- O \(\Delta H\) pode ser calculado por meio de três métodos distintos:
- Entalpia-padrão de formação: \(\sum \Delta H_{\text{f produtos}}^\circ - \sum \Delta H_{\text{f reagentes}}^\circ\).
- Lei de Hess: é necessário somar as reações intermediárias e os seus valores de \(\Delta H\) para se chegar à reação final desejada.
- Energia de ligação: \(\Delta H\) = energia absorvida (positiva) + energia liberada (negativa).
- A quebra de ligação é um processo endotérmico (\(\Delta H > 0\)) e ocorre nos reagentes.
- A formação de ligação é um processo exotérmico (\(\Delta H < 0\)) e ocorre nos produtos.
- O \(\Delta H\) pode apresentar valor positivo ou negativo, dependendo do processo:
- \(\Delta H\) positivo (\(\Delta H > 0\)): processo endotérmico — o sistema absorve calor;
- \(\Delta H\) negativo (\(\Delta H < 0\)): processo exotérmico — o sistema libera calor.
Fórmula da variação de entalpia
As reações que ocorrem a pressão constante podem ocorrer com variação do volume, com o sistema realizando trabalho sobre a vizinhança (expansão) ou com a vizinhança realizando trabalho sobre o sistema (compressão). Assim, em uma expansão, parte da energia fornecida ao sistema, na forma de calor, volta para a vizinhança na forma de trabalho (W), fazendo com que a energia interna (U) seja menor que o calor (q).
A variação de energia interna é definida como:
\(\Delta U = q + W \)
Considerando que o processo ocorre a pressão constante e que o único trabalho seja o de expansão, podemos considerar o \(W = -p \Delta V \).
Logo,
\(\Delta U = q_p - p \Delta V \)
Obs.: p é a pressão do sistema e \(\Delta V\) é a variação de volume.
Assim, temos que o calor a pressão constante (qp) é dado por
\(q_p = \Delta U + p \Delta V \)
O calor recebido pelo sistema a pressão constante é igual à variação de entalpia (ΔH) e a entalpia (H) é definida como:
H = U + pV
Como energia interna (U), pressão (p) e volume (V) são funções de estado, ou seja, propriedades que só dependem do estado inicial e final, a entalpia também é considerada uma função de estado, com sua variação dependendo apenas do estado inicial e final.
Assim, quando a pressão é constante, a variação de entalpia é dada por:
\(\Delta H = \Delta U + p \Delta V \)
Como:
\(\Delta U + p \Delta V = q_p \)
Temos que:
\(\Delta H = q_p \)
Obs.: \(\Delta H\) é igual ao calor transferido (qp).
Como grande parte das reações ocorrem a pressão constante, que é a pressão atmosférica, a troca de calor pode ser igualada à variação de entalpia. Dessa forma, em uma reação do tipo:
Reagentes → Produtos
A variação de entalpia é definida pela diferença entre as entalpias dos produtos e as entalpias dos reagentes:
\(\Delta H = H_{\text{produtos}} - H_{\text{reagentes}} \)
A energia na forma de calor é medida em joule (J), medida do Sistema Internacional de Unidades (SI). Entretanto, os valores também podem ser dados em calorias (cal) e as duas unidades apresentam a seguinte relação:
1 cal = 4,174 J
Como calcular variação de entalpia?
A variação de entalpia pode ser calculada por meio de três métodos distintos: entalpia-padrão de formação, Lei de Hess ou energia de ligação.
-
Entalpia-padrão de formação (\(\Delta H_f^\circ \))
Esse método considera os valores de entalpia-padrão de formação (\(\Delta H_f^\circ \)) de cada substância presente na reação. A variação de entalpia é dada pela diferença entre a soma das entalpias dos produtos e a soma das entalpias dos reagentes, como descrito a seguir.
\(\sum \Delta H_{\text{f produtos}}^\circ - \sum \Delta H_{\text{f reagentes}}^\circ\)
Exemplo:
Determine o \(\Delta H\) da reação de combustão do metano, descrita abaixo:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l)
Dados: \(\Delta H_f^\circ (\text{CH}_4 = -74{,}8\ \text{kJ/mol};\ \text{CO}_2 = -393{,}5\ \text{kJ/mol};\ \text{H}_2\text{O} = -286{,}0\ \text{kJ/mol}) \)
Perceba que a entalpia-padrão do gás oxigênio (O2) não foi dada. É importante lembrar que a entalpia-padrão de uma substância simples é igual a zero (considerando o alótropo mais estável).
Diante disso, é só fazermos a substituição dos valores na fórmula:
\(\sum \Delta H_{\text{f produtos}}^\circ - \sum \Delta H_{\text{f reagentes}}^\circ\)
Na substituição, os valores de entalpia-padrão são multiplicados pelos respectivos coeficientes estequiométricos de cada substância.
\(\Delta H\) = [(−393,5 KJ/mol) + 2.(−286,0KJ/mol)] – [(−74,8 KJ/mol) + 2.(0)]
\(\Delta H\) = –890,7 KJ/mol
Assim, a reação de combustão do gás metano libera 890,7 KJ/mol.
-
Lei de Hess
O cálculo da variação de entalpia por meio da Lei de Hess consiste na soma das reações intermediárias e os seus valores de \(\Delta H\)para se chegar à reação desejada e seu valor de \(\Delta H\).
Exemplo:
Determine a variação de entalpia (\(\Delta H\)) da reação de formação do metano:
C(gráfite) + 2 H2(g) → CH4(g) ΔH = ?
A partir das seguintes reações intermediárias:
\(Reação\ 1: C(grafite) + O_2(g) \rightarrow CO_2(g) \ \ \Delta H_1 = -394,0 \, \text{kJ} \\ Reação\ 2: H_2(g) + \frac{1}{2}O_2(g) \rightarrow H_2O \ \ \Delta H_2 = -286,0 \, \text{kJ} \\ Reação\ 3: CH_4(g) + 2O_2(g) \rightarrow CO_2(g) + 2H_2O \ \ \Delta H_3 = -890,0 \, \text{kJ}\)
Antes de fazermos o cálculo, é necessário reorganizar as reações de modo a obter os reagentes e os produtos no mesmo lado. O processo pode ser entendido por meio das etapas a seguir.
Etapa 1: é feito o reconhecimento das reações intermediárias fornecidas. A reação 1 mostra a combustão do grafite, levando à formação do gás carbônico (CO2). A reação 2 mostra a formação da água a partir dos gases hidrogênio (H2) e oxigênio (O2), enquanto a reação 3 mostra a reação de combustão do metano (CH4).
Etapa 2: é feita a manipulação das equações dadas, de modo que seja possível obter a equação da reação de interesse.
Dessa forma, devemos manter a equação 1 da mesma forma como foi dada, pois ela apresenta o grafite no lado dos reagentes (1), igual na equação de interesse:
\(Reação\ 1: C(grafite) + O_2(g) \rightarrow CO_2(g) \ \ \Delta H_1 = -394,0 \, \text{kJ} \\\)
A equação 2 precisa ser multiplicada por 2 para se ter a mesma quantidade de mol do gás hidrogênio existente na equação de interesse:
\(Reação\ 2: (H_2(g) + \frac{1}{2}O_2(g) \rightarrow H_2O \ \ \Delta H_2 = -286,0 \, \text{kJ})\ x2\\\)
Perceba que o valor do \(\Delta H\) também deve ser multiplicado por 2, pois a quantidade de reagentes consumidos na reação está dobrando, fazendo com que a variação de entalpia também dobre o seu valor.
\(Reação\ 2: 2 H_2(g) + O_2(g) → 2 H_2O(ℓ)\ \ \Delta H_2 = −572,0 KJ\)
A equação 3 precisa ser invertida, para que o metano fique no lado dos produtos, igual na equação de interesse. É importante atentar que, ao inverter a equação química, o valor de \(\Delta H\) também deve ser invertido, mudando o sinal:
\(Reação\ 3: CO_2(g) + 2 H_2O(ℓ) → CH_4(g) + 2 O_2(g) \ \ \Delta H_3 = +890,0 KJ\)
Etapa 3: Após realizar todas as alterações necessárias nas equações, é feita a soma das três reações. Nesse processo, as substâncias que estiverem em lados opostos da equação (uma no lado dos reagentes e outra no lado dos produtos) devem ser canceladas em quantidades iguais. No fim, os valores de \(\Delta H\) das três reações também são somados para dar o valor da variação de entalpia da reação de interesse.
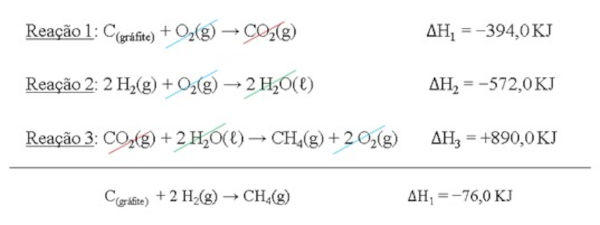
Dessa forma, é possível concluir que a formação do metano ocorre liberando 76,0 KJ de energia na forma de calor.
-
Energia de ligação
O cálculo da variação de entalpia por meio da energia de ligação se baseia na ideia de que, para que a reação ocorra, é necessário quebrar ligações nos reagentes e formar novas ligações nos produtos.
Para que ocorra quebra de ligação, os reagentes precisam absorver energia, o que caracteriza o processo como endotérmico (\(\Delta H > 0\)). Por outro lado, quando ocorre a formação de novas ligações, originando os produtos, há liberação de energia para que as novas ligações se estabeleçam e o processo é caracterizado como exotérmico (\(\Delta H < 0\)).
É importante destacar que os valores das entalpias de ligação são tabelados e o sinal positivo ou negativo deve ser atribuído dentro do contexto de quebra ou formação de ligação. Para entendermos melhor a aplicação desse método, vamos desenvolver o exemplo a seguir.
Exemplo:
Determine a variação da reação da reação a seguir:
3/2 H2(g) + ½ N2(g) → NH3(g)
Dados: Energias de ligação: H−H = 436,0 KJ/mol; N≡N = 945,4 KJ/mol; N−H = 391,0 KJ/mol.
Inicialmente, é preciso fazer o balanço de energia relacionada às ligações no lado dos reagentes e dos produtos, considerando que os valores dados são para 1 mol de ligação.
- Em 1 mol de H2, há 1 mol de ligações H−H. Como na reação há 3/2 mol de H2, há 3/2 mol de ligações H−H. Dessa forma, para quebrar 3/2 mol de ligações H−H, é necessário absorver 3/2 . 436,0 KJ = +654 KJ.
- Em 1 mol de N2, há 1 mol de ligações N≡N. Como na reação há 1/2 de N2, há 1/2 de ligações N≡N. Dessa forma, para quebrar 1/2 mol de ligações N≡N, é necessário absorver 1/2 . 945,4 KJ = + 472,7 KJ.
- Em 1 mol de NH3, há 3 mol de ligações N−H. Dessa forma, para formar 3 mol de ligações N−H, é necessário liberar 3 . (−391,0 KJ) = −1173 KJ.
Agora é só somar todos os valores de entalpia dos reagentes e produtos. O balanço energético é o valor da variação de entalpia da reação.
ΔH = 654 KJ + 472,7 KJ + (−1173 KJ)
ΔH = −46,3 KJ/mol
Assim, é possível concluir que a formação da amônia ocorre com liberação de 46,3 KJ de energia na forma de calor.
Variação de entalpia positiva e negativa
A variação de entalpia pode apresentar um valor positivo ou negativo, dependendo do tipo de processo:
- Quando a reação ocorre com absorção de calor, o processo é chamado de endotérmico e o valor de \(\Delta H\) é positivo (\(\Delta H > 0\)).
- Quando a reação ocorre com liberação de calor, o processo é chamado de exotérmico e o valor de \(\Delta H\) é negativo (\(\Delta H < 0\)).
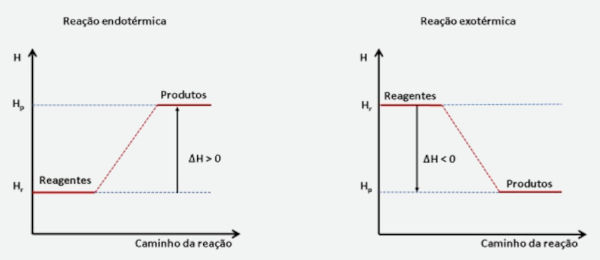
No processo endotérmico, os produtos apresentam uma energia maior que a dos reagentes (Hp > Hr) e, para que a reação ocorra, é necessário que o sistema absorva energia na forma de calor, cedido pela vizinhança. Isso resulta em uma variação de entalpia positiva, com \(\Delta H > 0\).
Já no processo exotérmico, os produtos apresentam uma energia menor que a dos reagentes (Hp < Hr) e, quando ocorre a formação dos produtos, há liberação de energia na forma de calor para a vizinhança. Isso resulta em uma variação de entalpia negativa, \(\Delta H < 0\).
Os processos endotérmico e exotérmico podem ser representados graficamente, como mostrado a seguir.
Exercícios sobre variação de entalpia
Questão 1
(Enem 2021) Grande parte da atual frota brasileira de veículos de passeio tem tecnologia capaz de identificar e processar tanto o etanol quanto a gasolina. Quando queimados, no interior do motor, esses combustíveis são transformados em produtos gasosos, num processo com variação de entalpia menor que zero (\(\Delta H < 0 \)). Esse processo necessita de uma energia de ativação, a qual é fornecida por uma centelha elétrica.
O gráfico que esboça a variação da energia potencial no progresso da reação é representado por:
A) 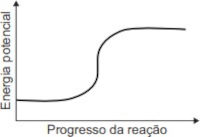
B)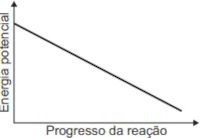
C)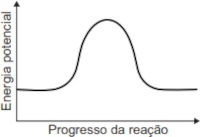
D)
E)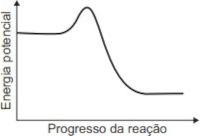
Resolução: A resposta correta é a letra E.
No enunciado da questão, é dito que os combustíveis são transformados em um processo com variação de entalpia menor que zero (\(\Delta H < 0\)).
Lembre-se de que um processo que ocorre com variação de entalpia menor que zero libera energia para a vizinhança. Isso ocorre porque os produtos apresentam energia menor que a dos reagentes (Hp < Hr), tal como mostra o gráfico da alternativa E.
Questão 2
(Enem 2019) O gás hidrogênio é considerado um ótimo combustível — o único produto da combustão desse gás é o vapor de água, como mostrado na equação química.
2 H2(g) + O2(g) → 2 H2O(g)
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
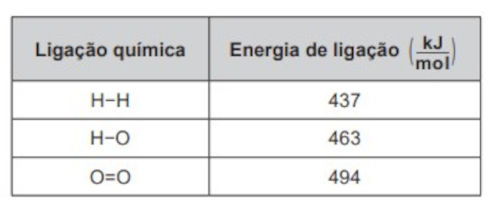
Massas molares ( g/mol ): H2 = 2; O2 = 32; H2O = 18.
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
A) −242 000
B) −121 000
C) −2 500
D) +110 500
E) +234 000
Resolução: A resposta correta é a letra B) −121 000.
Primeiro, devemos calcular a variação de entalpia para a reação por meio da energia de ligação, utilizando os valores das energias de ligação dados no quadro da questão.
Lembre-se de que:
- ΔH = energia absorvida (reagentes) + energia liberada (produtos);
- Quebra de ligação é um processo endotérmico (\(\Delta H > 0\)) – ocorre nos reagentes;
- Formação de ligação é um processo exotérmico (\(\Delta H < 0\)) – ocorre nos produtos.
Considerando a reação:
2 H2(g) + O2(g) → 2 H2O(g)
Temos:
- 2 mol de ligações H−H, que precisam absorver 2 x (437 KJ) = 874 KJ.
- 1 mol de ligações O=O, que precisam absorver 494 KJ.
- 4 mol de ligações H−O, que, ao se formar, liberam 4 x (−463 KJ) = −1.852 KJ.
Dessa forma, o cálculo da variação de entalpia é dado por:
ΔH = 874 KJ + 494 KJ + (−1.852 KJ)
ΔH = −484 KJ para 2 mol de H2.
Em 2 mol de H2, há 4 g de H2.
Atente ao fato de que, na questão, é pedido o valor da variação de entalpia para a quantidade de hidrogênio contida no cilindro, que é de 1 kg.
1 kg = 1000 g
Assim, seguimos com a seguinte regra de três:
4 g ----------- −484 KJ
1000 g ----------- x
x = −121.000 KJ
Fontes:
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3ª ed.; Porto Alegre; Bookman; 2006.
CHANG, Raymond. Química Geral: Conceitos Essenciais. 4ªed.; São Paulo; McGraw-Hill; 2007.
ATKINS, P. W. PAULA, J. de. Fundamentos de Físico-Química. Vol 1 & 2. 5 ed. Rio de Janeiro: LTC, 2003.

