Energia de ativação é a energia mínima para que uma reação química possa ocorrer, ou seja, é um dos fatores determinantes para a ocorrência de uma reação, juntamente com o contato e a colisão favorável entre as moléculas dos reagentes.
Modelo de colisão favorável entre os reagentes de uma reação
Quando há o contato e a colisão entre as moléculas dos reagentes, há a formação de um composto intermediário (antes da formação do produto), denominado complexo ativado. Esse complexo é um grupamento de todos os átomos dos reagentes.
Representação do complexo ativado
Porém, o tempo para formar o complexo ativado indica se uma reação química será mais rápida ou mais lenta que a outra. Assim, a colisão favorável, aliada à energia de ativação, é determinante para a velocidade da reação.
É preciso ressaltar que a energia de ativação não cessa enquanto o complexo ativado não estiver formado.
A forma mais comum de analisar a energia de ativação e o complexo ativado é utilizando um gráfico, o qual apresenta, como padrão, energia ou entalpia (em KJ ou Kcal) no eixo y, o caminho da reação (do reagente em direção aos produtos) no eixo x, e uma curva, como podemos ver a seguir:
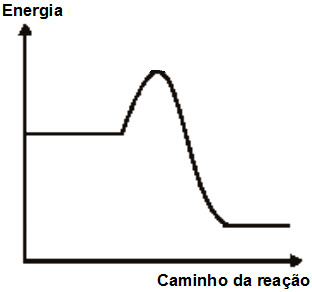
Modelo de um gráfico padrão utilizado em cinética química
Nesse modelo de gráfico, o complexo ativado é dado pelo ponto mais alto da curva (ponto a do próximo gráfico), e a energia de ativação é todo o percurso dos reagentes até o complexo ativado (seta vermelha no gráfico):
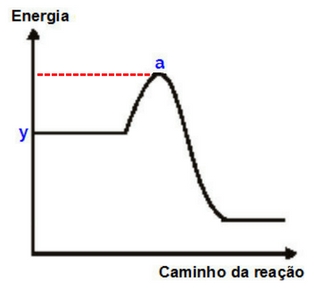
Verificação do complexo e da energia de ativação no gráfico
Para determinar o valor da energia de ativação, então, basta subtrair da energia do complexo ativado a energia dos reagentes, como na expressão matemática abaixo:
Eat = Hcomplexo ativado – Hreagentes
Suponha, por exemplo, que uma reação química esteja ocorrendo entre os reagentes AB e CD, para a formação dos produtos AD e CB, de acordo com o seguinte gráfico:
AB + CD → AD + CB
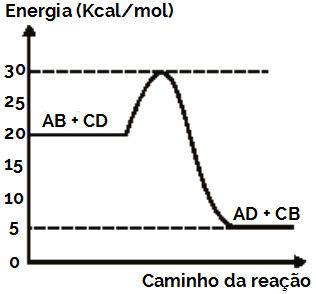
Gráfico da reação de formação de AD e CB
Analisando esse gráfico, temos que:
-
A energia necessária para a formação do complexo ativado é de 30 Kcal, por ser a energia relacionada ao ponto mais elevado da curva;
-
A energia de ativação dessa reação seria de 10 Kcal apenas, porque ela parte dos reagentes que apresentam energia de 20 Kcal e termina no complexo ativado que apresenta energia de 30 Kcal, conforme demonstrado a seguir:
Eat = Hcomplexo ativado – Hreagentes
Eat = 30 – 20
Eat = 10 Kcal
Uma forma de tornar uma reação química mais veloz, pelo que vimos, é reduzindo a energia de ativação, pois, quanto menor ela for, mais rápido o complexo ativado será formado e, consequentemente, mais rápida será a obtenção dos produtos.
Para reduzir a energia de ativação e, assim, acelerar a reação, uma alternativa é utilizar um catalisador, o qual é uma substância química que deve ser adicionada ao meio reacional (reação), que participa da formação do complexo ativado, porém não forma nenhuma substância no produto, ou seja, é recolhido ao final e pode ser reutilizado.
Graficamente, a presença do catalisador é notada pelo incremento de uma segunda curva, como podemos observar abaixo:
.jpg)
Gráfico que apresenta a curva com um catalisador
Dessa forma, a curva com o catalisador (em vermelho) apresenta uma nova energia de ativação (seta azul) e um novo valor (x) de energia para o complexo ativado, sempre mais baixo com relação à curva da reação realizada sem a presença do catalisador.
Por Me. Diogo Lopes Dias
