A lei de Hess foi proposta em 1840 pelo médico e químico suíço Germain Henri Hess. Durante seus trabalhos sobre a energia na forma de calor em reações de neutralização de ácidos e bases, ele concluiu que a soma das energias nesse tipo de reação era sempre constante.
Os estudos do cientista suíço levaram à proposição da seguinte lei:
“A variação da entalpia envolvida em uma reação química, sob certas condições experimentais, depende exclusivamente da entalpia inicial e final dos produtos, seja a reação executada diretamente em uma única etapa, seja executada indiretamente em uma série de etapas.”
De uma forma geral, o cálculo do ?H de uma reação independe do número de etapas e do tipo de reação e é feito pela seguinte expressão:
?H = Hp-Hr
Quando não temos condição de calcular o ?H de uma reação química específica, podemos determiná-lo pela soma dos ?Hs das etapas que formam essa reação:
?H = ?H1 + ?H2 + ?H3 + ...
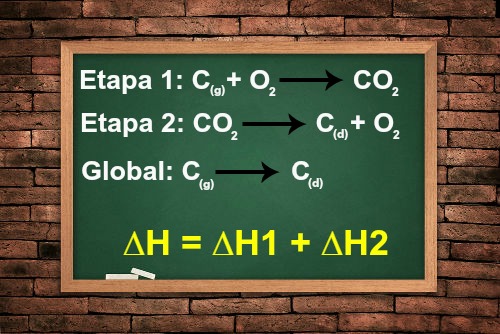
Um exemplo é a determinação da energia envolvida na transformação do carbono grafite em carbono diamante (C(g) → C(d)). Para determinar o ?H desse processo, temos à nossa disposição as seguintes etapas:
C(g) + O2(g) → CO2(g) ?H = -94 Kcal
CO2(g) → C(d) + O2(g) ?H = +94,5 Kcal
Como existem compostos que se repetem (CO2 e O2) em ambas as equações, mas em áreas diferentes (reagentes ou produtos), eles são eliminados. Assim, basta somar os ?Hs fornecidos, já que tanto o O2 quanto o CO2 estão em lados opostos da equação:
?H = ?H1 + ?H2
?H = -94 + 94,5
?H = 0,5 Kcal
Fundamentos da Lei de Hess
Quando temos que calcular a variação da entalpia de uma reação a partir de suas etapas e suas variações de entalpia, temos que ter em mente que a reação final é quem vai ditar esse cálculo.
Todas as etapas fornecidas são trabalhadas de forma que estejam totalmente de acordo com a reação final. Por exemplo, se tivermos uma reação final:
Reação global: X + Y → Z
E o exercício fornecer as seguintes etapas:
Etapa 1: X + D → W + E
Etapa 2: Z + D → F + E
Etapa 3: F → Y + W
Fica claro que as etapas 2 e 3 não estão obedecendo à reação final, já que, na 2, o A está no reagente e, na 3, o Y está no produto. Nesse caso, essas etapas precisam de “tratamento” para obedecer à reação final ou global. Entenda o que é esse “tratamento”:
Possibilidades de trabalho com as etapas de uma reação na Lei de Hess
a) Inverter a equação toda
Uma equação pode ser invertida (reagentes viram produtos, e produtos viram reagentes) com o objetivo de igualar a posição dos participantes. Nesse caso, o valor do ?H terá o seu sinal invertido.
No exemplo abaixo, fica evidente que as etapas 2 e 3 devem ser invertidas:
Reação global: X + Y → Z
Etapa 1: X + D → W + E
Etapa 2: Z + D → F + E
Etapa 3: F → Y + W
b) Multiplicar a equação
Uma equação pode ser multiplicada por qualquer valor numérico com o objetivo de igualar a quantidade dos participantes. Nesse caso, o valor do ?H deve ser multiplicado.
No exemplo abaixo, fica evidente que a etapa 2 deve ser multiplicada por 2 para igualar a quantidade dos participantes B e C em relação à equação global.
Reação global: A + 2B → 2C
Etapa 1: A + 2D → 2Z
Etapa 2: Z + B → C + D
c) Dividir toda a equação
Uma equação pode ser dividida por qualquer valor numérico com o objetivo de igualar a quantidade dos participantes. Nesse caso, o valor do ?H também deve ser dividido.
No exemplo abaixo, fica evidente que a etapa 2 deve ser dividida por 2 para igualar a quantidade dos participantes F e C em relação à equação global.
Reação global: W + F → 2C
Etapa 1: W + 2D → 2Z
Etapa 2: 4Z + 2F → 4C + 4D
Exemplo de aplicação da Lei de Hess
Exemplo: A reação de combustão completa (formação de gás carbônico e água) do gás butano é dada pela seguinte equação:
C4H10(g) + 13/2O2(g) → 4CO2(g) + 5 H2O(g)
Sabendo que o butano, C4H10, é o gás presente em maior quantidade no gás de cozinha (GLP), determine o valor da sua entalpia, tendo como referência os seguintes dados para entalpias-padrão de formação de cada um de seus componentes:
C(s) + 5H2(g) → 1C4H10(g) ?H = -125 Kcal
C(s) + O2(g) → CO2(g) ?H = -394 Kcal
H2(g) + 1/2O2(g) → H2O(g) ?H = -242 Kcal
Resolução:
1o Passo: A etapa 1 deve ser invertida, pois, de acordo com a equação global, a substância deve ser reagente, e não produto. Com isso, o sinal do valor do ?H é invertido também:
1C4H10(g) → 4 C(s) + 5H2(g) ?H = + 125 Kcal
2o Passo: A etapa 2 deve ser mantida, mas terá que ser multiplicada por quatro, pois, de acordo com a equação global, deve apresentar 4 mol de CO2. Com isso, o valor do ?H deve ser multiplicado por 4 também:
(4x) C(s) + O2(g) → CO2(g) ?H = -394 Kcal
logo:
4 C(s) + 4 O2(g) → 4 CO2(g) ?H = -1576 Kcal
3o Passo: A etapa 3 deve ser mantida, mas terá que ser multiplicada por cinco, pois, de acordo com a equação global, deve apresentar 5 mol de H2O. Com isso, o valor do ?H deve ser multiplicado por 5 também:
(5x) H2(g) + 1/2O2(g) → H2O(g) ?H = -242 Kcal
logo:
5 H2(g) + 5/2O2(g) → 5H2O(g ?H = -1210 Kcal
4o Passo: Realizar as eliminações:
Etapa 1: 1C4H10(g) → 4 C(s) + 5H2(g) ?H = + 125 Kcal
Etapa 2: 4 C(s) + 4 O2(g) → 4 CO2(g) ?H = -1576 Kcal
Etapa 3: 5 H2(g) + 5/2O2(g) → 5H2O(g ?H = -1210 Kcal
-
Há 5 H2 no produto da etapa 1 e no reagente da etapa 3, por isso, são eliminados;
-
Há 4 C no produto da etapa 1 e no reagente da etapa 2, por isso, são eliminados.
Não pare agora... Tem mais depois da publicidade ;)
Restam, assim, as etapas da seguinte forma:
Etapa 1: 1C4H10(g) → ?H = + 125 Kcal
Etapa 2: + 4 O2(g) → 4 CO2(g) ?H = -1576 Kcal
Etapa 3: + 5/2O2(g) → 5H2O(g ?H = -1210 Kcal
Ao somar as etapas após as eliminações, percebemos que elas estão de acordo com a reação global.
C4H10(g) + 13/2O2(g) → 4CO2(g) + 5 H2O(g)
5o Passo: Somar os valores dos ?Hs das etapas para determinar o ?H da reação global.
?H = ?H1 + ?H2 + ?H3
?H = 125 + (-1576) + (-1210)
?H = 125 – 1576 – 1210
?H = 125 – 2786
?H = - 661 Kcal
Por Me. Diogo Lopes Dias