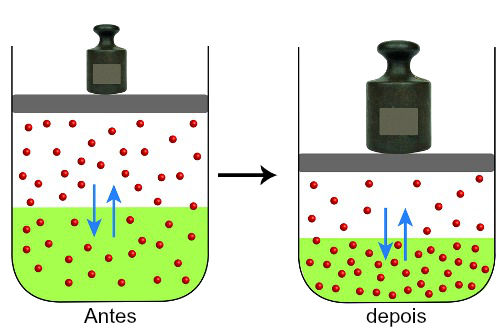
Segundo o químico francês Henry Louis Le Chatelier, deslocamento de equilíbrio é uma situação em que uma reação química é deslocada (para o sentido direto ou para o sentido inverso) quando submetida a uma perturbação externa. Essa afirmação proposta pelo químico passou a ser conhecida como princípio de Le Chatelier.
Obs.: reação direta é aquela em que os reagentes se transformam em produtos, já a reação inversa é aquela em que os produtos se transformam em reagentes.
Uma reação está em equilíbrio quando a velocidade da reação direta é a mesma da reação inversa, ou seja, os reagentes se transformam em produtos com a mesma velocidade com que os produtos se transformam em reagentes.

Representação geral de uma reação química em equilíbrio
De acordo com o princípio de Le Chatelier, sempre que uma força atuar sobre uma reação em equilíbrio, o deslocamento de equilíbrio irá ocorrer no sentido de anular essa perturbação e estabelecer uma nova situação de equilíbrio na reação.
As perturbações capazes de deslocar um equilíbrio químico são:
Quando a concentração em quantidade de matéria (em mol/L ou molar) de um participante da reação é alterada (seja diminuída ou aumentada), irá ocorrer o deslocamento do equilíbrio, desde que esse participante não esteja no estado sólido.
Assim, de acordo com o princípio de Le Chatelier, se a concentração de um participante for aumentada, ocorrerá o deslocamento do equilíbrio no sentido contrário ao aumento. Porém, se a concentração do participante for reduzida, ocorrerá o deslocamento do equilíbrio no sentido da diminuição. Por exemplo:

Representação geral de uma reação química em equilíbrio
-
Aumentando a concentração de A = equilíbrio desloca para a direita
-
Diminuindo a concentração de B = o equilíbrio desloca para a esquerda
→ Variação da pressão
A variação da pressão só promove deslocamento em equilíbrios que apresentam componentes gasosos, já que quando ela é aumentada as moléculas ampliam os choques entre si, e quando a pressão é diminuída, elas diminuem os choques entre si.
Os choques entre as moléculas aumentam com o aumento da pressão, porque o volume (espaço) é diminuído consequentemente, enquanto que a diminuição da pressão é acompanhada com o aumento do volume.
Obs.: Em um equilíbrio químico, a análise do efeito da modificação da pressão leva em consideração o volume molar dos reagentes e produtos, volume esse que está relacionado com os coeficientes da reação. Na equação abaixo o volume do reagente é 4 e do produto é 2.
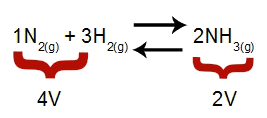
Equação que indica os volumes presentes na formação da amônia
De acordo com o princípio de Le Chatelier, se a pressão de um sistema for aumentada, ocorrerá o deslocamento do equilíbrio no sentido de maior volume, enquanto que se a pressão for diminuída ocorrerá o deslocamento do equilíbrio.
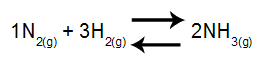
Equação que representa o equilíbrio de formação da amônia
-
Aumentando a pressão = equilíbrio desloca para a direita (por ser o lado de menor volume).
-
Diminuindo a pressão = o equilíbrio desloca para a esquerda (por ser o lado de maior volume).
O aumento da temperatura de uma reação em equilíbrio favorece para que as moléculas se choquem mais, enquanto que a diminuição da temperatura diminui a agitação delas e, consequentemente, os choques. Sendo que o aumento da temperatura sempre favorece reação endotérmica (aquele que absorve energia).
A análise do efeito da temperatura em um equilíbrio leva em consideração, principalmente, o ΔH da reação. Se o ΔH for positivo, a reação direta será endotérmica, enquanto a inversa será exotérmica. Caso o ΔH seja negativo, a direta será exotérmica e a inversa, endotérmica.
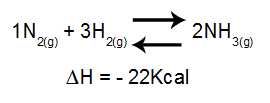
Equação contendo a variação de entalpia na formação da amônia
-
Aumentando a temperatura = equilíbrio desloca para a esquerda (por ser o sentido da reação endotérmica, já que o ΔH é negativo).
-
Diminuindo a temperatura = o equilíbrio desloca para a direita (por ser o sentido da reação exotérmica, já que o ΔH é negativo).
Por Me. Diogo Lopes Dias