Reações de simples troca entre metais são fenômenos químicos que podem ocorrer apenas quando uma substância simples, que deve ser obrigatoriamente um metal, é colocada em um mesmo recipiente que uma substância composta.
Convencionalmente, a reação de simples troca entre metais também é chamada de reação de deslocamento. Isso porque o metal (A) da substância simples troca de posição com o cátion (Y) da substância composta (YC), conforme o representado na equação genérica a seguir:
A + YC → AC + Y
Porém, a reação de simples troca entre metais ocorre apenas se a substância simples metálica for mais eletropositiva, ou seja, mais reativa que o cátion presente na substância composta.
Para auxiliar, segue abaixo um esquema contendo a ordem decrescente de eletropositividade dos principais elementos químicos que participam de reações de simples troca entre metais:
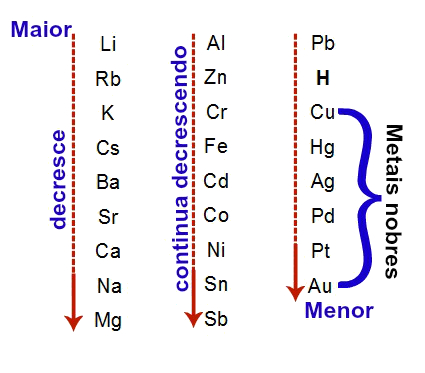
Em ordem decrescente de eletropositividade, enfatizamos os metais nobres
Nessa ordem, o elemento lítio apresenta a maior eletropositividade, enquanto o elemento ouro a menor. Todos os elementos localizados abaixo do hidrogênio são denominados metais nobres.
Obs.: Os metais nobres são aqueles que apresentam uma eletropositividade muito baixa, ou seja, a capacidade de reação química desses metais é muito limitada. De uma forma geral, um metal nobre seria capaz de deslocar apenas outro metal nobre.
1º Exemplo: Reação entre o cobre metálico e o ácido clorídrico.
Cu(s) + HCl → Não ocorre
Essa reação de simples troca não ocorre porque o alumínio é um elemento metálico menos eletropositivo que o cátion sódio presente na substância composta, não sendo, portanto, capaz de deslocá-lo.
2º Exemplo: Reação entre o alumínio metálico e o brometo de sódio (NaBr).
Al(s) + NaBr → Não ocorre
Essa reação de simples troca também não ocorre porque o alumínio é um elemento metálico menos eletropositivo que o cátion sódio (Na+), presente na substância composta, o que o torna incapaz de deslocá-lo.
3º Exemplo: Reação entre o potássio e o sulfato de cobre II.
K + CuSO4 →
Essa reação de simples troca ocorre porque o potássio é um elemento metálico mais eletropositivo que o cobre. Assim, o potássio desloca o cobre, gerando as seguintes alterações:
- Transformação do cobre na substância simples Cu;
- Formação do sal denominado sulfato de potássio (K2SO4), resultante da união do potássio (que possui carga +1, por ser da família IA) com o ânion sulfato (SO4-2).
A seguir, a equação balanceada que representa esse processo:
2 K(s) + CuSO4 → Cu(s) + K2SO4
4º Exemplo: Reação entre o magnésio metálico e o cloreto de ferro III.
Mg + FeCl3 →
A reação de simples troca ocorre porque o magnésio é um elemento metálico mais eletropositivo que o ferro. Assim, o magnésio desloca o ferro e gera as seguintes alterações:
- Transformação do ferro na substância simples Fe;
- Formação do sal denominado cloreto de magnésio (MgCl2), resultante da união do magnésio (que possui carga +2, por ser da família IIA) com o ânion cloreto (Cl-1).
A seguinte equação balanceada representa esse processo:
3 Mg(s) + 2 FeCl3 → 2 Fe(s) + 3 MgCl2
5º Exemplo: Reação entre alumínio e ácido sulfúrico.
Essa reação de simples troca ocorre porque o alumínio é um elemento metálico mais eletropositivo que o hidrogênio. Assim, o alumínio desloca o hidrogênio e gera as seguintes alterações:
- Transformação do hidrogênio na substância simples gás hidrogênio (H2);
- Formação do sal denominado sulfato de alumínio [Al2(SO4)3], resultante da união do alumínio (que possui carga +3, por ser da família IIIA) com o ânion sulfato (SO4-2 ).
A seguir, a equação balanceada que representa esse processo:
2 Al(s) + 3 H2SO4 → 3 H2(g) + Al2(SO4)3
Por Me. Diogo Lopes Dias

