Kc é a sigla que representa a constante de equilíbrio em termos de concentração de uma determinada reação química. Ela é utilizada sempre que nos referimos ao estabelecimento ou não de equilíbrio em uma reação química. Para tal, é sempre necessário realizar um cálculo do Kc, que utiliza as concentrações em quantidade de matéria dos participantes da reação.
A interpretação do Kc é muito simples, pois, quando:
-
Kc = 1, o sistema reacional está em equilíbrio;
-
Kc > 1, o sistema não está em equilíbrio e a reação direta está predominando;
-
Kc < 1, o sistema não está em equilíbrio e a reação inversa está predominando.
É importante ressaltar que a interpretação do Kc depende do conhecimento sobre o equilíbrio químico.
Temos um equilíbrio químico quando uma reação química é reversível, ou seja, apresenta reação direta (reagentes formam os produtos) e reação inversa (produtos formam os reagentes), e a velocidade da reação direta é exatamente igual à velocidade da reação inversa. Veja um exemplo:

No exemplo acima, temos um equilíbrio químico (indicado pelas duas setas), pois há a reação direta (A +B formando C+D) e a reação inversa (C+D formando A+B). Os coeficientes a, b, c, d tornam a equação balanceada.
Cada um dos participantes de uma reação sempre apresenta uma concentração em quantidade de matéria (mol/L). Com os valores das concentrações, podemos calcular o Kc da reação. Todavia, para realizar esse cálculo, é necessário montar a expressão do Kc.
A montagem da expressão do Kc utiliza sempre um mesmo padrão. Com esse padrão, multiplicamos as concentrações dos produtos elevados aos seus respectivos expoentes e dividimos pela multiplicação dos reagentes elevados aos seus respectivos expoentes.
A expressão do Kc para o equilíbrio genérico abaixo seria:

Kc = [C]c.[D]d
[A]a.[B]b
Na expressão de Kc, nunca utilizamos participantes sólidos ou a água no estado líquido, pois eles são itens constantes na reação.
Veja alguns exemplos:
Exemplo 1: Equilíbrio de formação da amônia
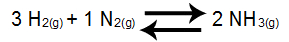
No equilíbrio acima, o produto é o NH3, que apresenta coeficiente 2, e os reagentes são o H2 e o N2, que apresentam, respectivamente, os coeficientes 3 e 1. Todos os participantes do equilíbrio são gasosos, logo, podem fazer parte do Kc. A partir desses dados, a expressão do Kc será:
Kc = [NH3]2
[H2]3.[N2]1
Exemplo 2: Equilíbrio da decomposição do carbonato de cálcio
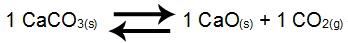
No equilíbrio acima, os produtos CaO e o CO2 e o reagente CaCO3 apresentam coeficiente 1. Como CaCO3 e CaO são sólidos, não podem fazer parte do Kc. A partir desses dados, a expressão do Kc do equilíbrio será:
Kc = [CO2]1
OBS.: A expressão não apresentará denominador porque o reagente é sólido. Assim, deixamos a expressão sem denominador ou colocamos o número 1 no denominador (número que indica a constância de um participante).
Exemplo 3: Equilíbrio de formação do cloreto de amônio
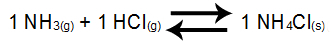
No equilíbrio acima, os reagentes NH3 e o HCl e o produto NH4Cl apresentam coeficiente 1. Como o participante do equilíbrio NH4Cl é sólido, não pode fazer parte do Kc. A partir desses dados, a expressão do Kc do equilíbrio será:
Kc = 1
[NH3]1.[HCl]1
OBS.: Como não temos nenhum participante do equilíbrio no numerador, é necessário colocar o número 1 (número que indica a constância de um participante).
Por Me. Diogo Lopes Dias
