O diagrama de fases é um gráfico muito particular que mostra, por meio de diversas regiões, como o estado físico de uma substância se comporta em função de seus valores de temperatura e pressão. Cada setor do diagrama de fases é demarcado por uma curva específica: fusão, vaporização e sublimação. Em alguns pontos específicos, é possível apresentar as condições para que mais de um estado físico de uma substância possa coexistir.
Além do mais, é possível ainda encontrar uma zona crítica onde seja impossível distinguir a substância entre líquido e gasoso. É muito comum usar a água como um exemplo prático para ilustrar os estados característicos, já que é uma substância com mudanças de estado bem perceptíveis.
Leia também: Afinal, o que é uma substância?
Tópicos deste artigo
- 1 - Resumo sobre diagrama de fases
- 2 - Quais os elementos do diagrama de fases?
- 3 - Como funciona o diagrama de fases?
- 4 - Diagrama de fases da água
- 5 - Exercícios resolvidos sobre diagrama de fases
Resumo sobre diagrama de fases
- Diagrama de fases é um gráfico de temperatura x pressão, com diversas zonas demarcadas.
- Os principais elementos de um diagrama de fases são suas curvas de mudança de estado e os pontos onde elas podem coexistir.
- Para trabalhar com um diagrama de fases, é necessário, para uma substância, saber os valores de pressão e temperatura em que se encontra.
- O diagrama de fases da água pode apresentar as diversas situações em que ela pode ser encontrada em mais de um estado físico.
Quais os elementos do diagrama de fases?
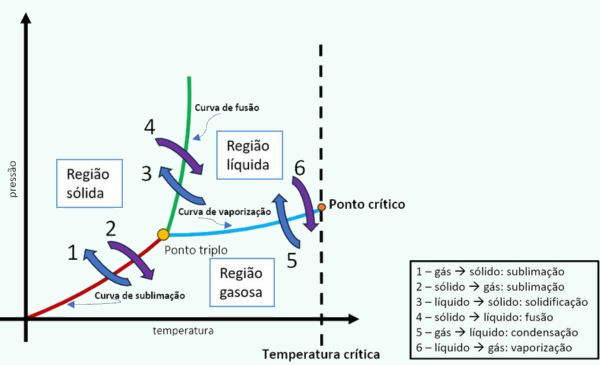
- Curva de fusão: curva que representa a transição do estado sólido para o estado líquido.
- Curva de vaporização: curva que representa a transição do estado líquido para o estado gasoso.
- Curva de sublimação: curva que representa a transição do estado sólido para o estado gasoso.
- Ponto triplo do diagrama de fases: ponto específico do diagrama onde os três estados físicos coexistem em equilíbrio termodinâmico.
- Ponto crítico: ponto ao final da curva de vaporização, marcando a condição limite onde não é mais possível distinguir entre os estados líquido e gasoso. Acima desse ponto, não é possível mais distinguir as propriedades entre líquidos e gases.
Como funciona o diagrama de fases?
Para compreender um diagrama de fases, é necessário saber os seguintes detalhes:
- Eixos: o eixo horizontal demarca os valores de temperatura, enquanto o eixo vertical mostra os valores de pressão.
- Regiões: as áreas demarcadas no diagrama apresentam os estados da matéria.
- Curvas de equilíbrio: linhas que separam as regiões do estado físico e marcam as condições onde duas fases podem coexistir em equilíbrio térmico.
- Ponto triplo: único ponto onde os três estados coexistem em equilíbrio térmico.
Então, para interpretar um diagrama de fases, é preciso verificar quais mudanças de estado ocorrem pelas curvas de equilíbrio, ou seja, pela influência da temperatura e pressão.
Saiba mais: O que pode alterar a velocidade de uma reação química?
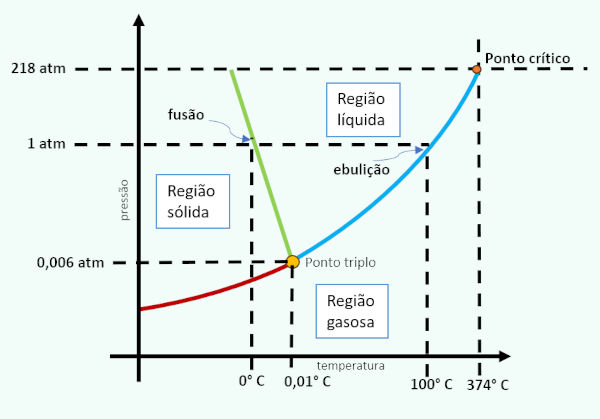
Diagrama de fases da água
O diagrama de fases da água é uma representação gráfica que apresenta as condições de pressão e temperatura, especificamente da água, onde se encontram diferentes estados físicos (sólido, líquido e gasoso). O diagrama revela as mudanças de estado e também indica seu ponto triplo e o ponto crítico.
Exercícios resolvidos sobre diagrama de fases
1. (Unesp 2013) A liofilização é um processo de desidratação de alimentos que, além de evitar que seus nutrientes saiam junto com a água, diminui bastante sua massa e seu volume, facilitando o armazenamento e o transporte. Alimentos liofilizados também têm seus prazos de validade aumentados, sem perder características como aroma e sabor.

O processo de liofilização segue as seguintes etapas:
I. O alimento é resfriado até temperaturas abaixo de 0 °C, para que a água contida nele seja solidificada.
II. Em câmaras especiais, sob baixíssima pressão (menores do que 0,006 atm), a temperatura do alimento é elevada, fazendo com que a água sólida seja sublimada. Dessa forma, a água sai do alimento sem romper suas estruturas moleculares, evitando perdas de proteínas e vitaminas.
O gráfico mostra parte do diagrama de fases da água e cinco processos de mudança de fase, representados pelas setas numeradas de 1 a 5.
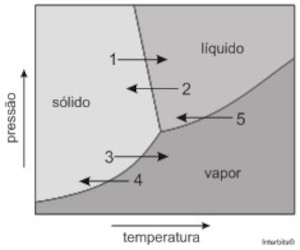
A alternativa que melhor representa as etapas do processo de liofilização, na ordem descrita, é
a) 4 e 1.
b) 2 e 1.
c) 2 e 3.
d) 1 e 3.
e) 5 e 3.
Resposta: [C].
Etapa I: a água sofre solidificação, passando da fase líquida para a sólida, processo indicado pela seta 2.
Etapa II: o gelo sofre sublimação, passa da fase sólida para vapor, processo indicado pela seta 3.
2. (UFMG 2010) Considere estas informações:
- a temperaturas muito baixas, a água está sempre na fase sólida;
- aumentando-se a pressão, a temperatura de fusão da água diminui.
Assinale a alternativa em que o diagrama de fases pressão versus temperatura para a água está de acordo com essas informações.
a) 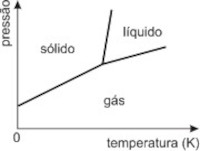
b) 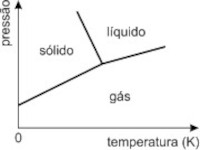
c) 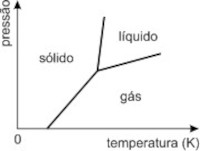
d) 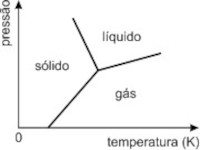
Resposta: [D].
De imediato eliminamos as opções a) e b), pois a baixas temperaturas a água está na fase gasosa. A opção c) apresenta aumento de temperatura de fusão com o aumento de pressão.
Abaixo mostramos a coerência da opção d) com o enunciado: pA > pB TA < TB.
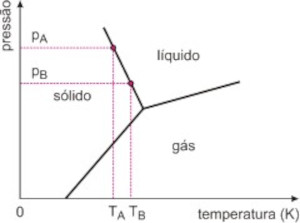
Fontes
HALLIDAY, David; RESNICK, Robert; WALKER, Jearl (colab.). Fundamentos de física: gravitação, ondas e termodinâmica, volume 2. 10. ed. Rio de Janeiro: LTC - Livros Técnicos e Científicos, 2016.
HEWITT, P. G. Física conceitual. 9. ed. Porto Alegre: Bookman, 2002.
![Conceito e representação padrão de um diagrama de fases. [imagem_principal] Conceito e representação padrão de um diagrama de fases. [imagem_principal]](https://s2.static.brasilescola.uol.com.br/be/2025/08/conceito-e-representacao-padrao-de-um-diagrama-de-fases-imagem-principal.jpg)
