PUBLICIDADE
Sabemos que os processos termodinâmicos (adiabático, isotérmico, isobárico ou isovolumétrico) produzem variações nas características de um sistema. Podemos usar a Primeira lei da Termodinâmica para verificar a conservação de energia nos processos termodinâmicos.
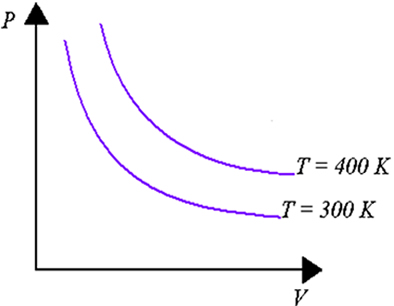
Processos isotérmicos são aqueles em que a temperatura do sistema é mantida constante. No diagrama PV as curvas que representam esses processos se chamam isotermas. Duas isotermas diferentes não se cruzam: caso houvesse um ponto comum, esse ponto corresponderia a duas temperaturas para um mesmo valor de P, V e n, o que é impossível. Veja o gráfico acima.
Para um gás ideal, a energia só depende da temperatura. Quando a temperatura permanecer constante, a energia interna não muda.
Se ∆T=0,então ∆U=0
Pela primeira lei da Termodinâmica, temos:
Q=τ+∆U
Q=τ
Em uma transformação isotérmica, o gás pode ceder ou receber calor do meio. Quando o gás recebe calor, o trabalho realizado é equivalente ao calor recebido. Quando o gás cede calor para o meio, o trabalho realizado sobre o gás corresponde ao calor cedido.
Por Domiciano Marques
Graduado em Física