De acordo com a Primeira Lei da Termodinâmica, em qualquer processo termodinâmico a quantidade de calor Q recebida por um sistema é igual ao trabalho realizado por ele mais a variação da sua energia interna.
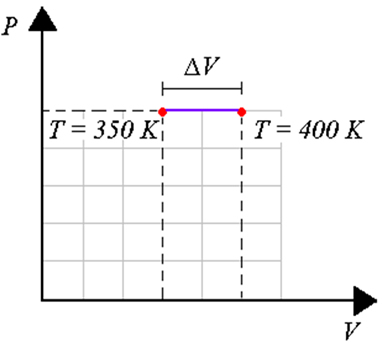
Quando a pressão é constante, o calor trocado pelo sistema com o meio externo é usado para o trabalho e para mudar a energia interna. Em muitas situações práticas, os sistemas estão submetidos à pressão atmosférica, como no caso de uma reação química. A figura acima mostra o diagrama PV desse tipo de processo.
Nesse caso, na equação da Primeira Lei,
Q=τ+∆U
nenhum dos termos é zero. O trabalho é escrito em função da variação do volume ΔV, como:
τ=P.∆V
Para o caso particular de um gás ideal monoatômico, a energia pode ser escrita da seguinte forma:
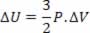
Portanto, podemos escrever a Primeira lei da Termodinâmica em função de ΔV:
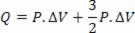
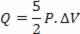
O calor trocado com o meio é (5/2)P.ΔV, sendo que 40% do total – que corresponde a P.ΔV –, são usados para realizar trabalho; e (3/2)P.ΔV, que corresponde a 60% do total, são usados pra alterar a energia interna. Esse resultado é válido para um gás monoatômico ideal.
O calor está relacionado à variação da temperatura (usando-se a lei dos gases ideais) por:
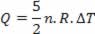
Assim, o calor fornecido pode ser calculado pela variação de temperatura ou pela variação de volume.
Por Domiciano Marques
Graduado em Física