O iodo (I) é um elemento químico ametal que pertence à serie dos halogênios e está localizado no grupo 17 (antiga família 7A) e 5º período da Tabela Periódica. Ele faz parte de um grupo de elementos essenciais para a saúde humana, desempenhando um papel crucial no funcionamento da glândula tireoide, que regula o metabolismo e diversas funções vitais do corpo. Sua presença na alimentação é indispensável para prevenir doenças como o hipotireoidismo e o bócio. Encontrado principalmente em frutos do mar, algas e no sal iodado, ele tem também importantes aplicações médicas, como antisséptico.
Leia também: Flúor — elemento químico muito eficiente no tratamento contra a cárie
Tópicos deste artigo
- 1 - Resumo sobre iodo
- 2 - O que é iodo?
- 3 - Para que serve o iodo?
- 4 - Características do iodo
- 5 - Propriedades do iodo
- 6 - Obtenção do iodo
- 7 - Efeitos do iodo no organismo
- 8 - Alimentos com iodo
- 9 - Tintura de iodo
- 10 - Precauções com o iodo
- 11 - História do iodo
Resumo sobre iodo
- O iodo é um elemento químico de símbolo I, número atômico 53 e massa atômica 126,9.
- É um ametal que pertence à série química dos halogênios.
- Tem cor violeta-escura e se sublima facilmente (passa de sólido para gasoso).
- É essencial para o funcionamento da glândula tireoide, que regula o metabolismo.
- É encontrado em frutos do mar, algas, laticínios, ovos e sal iodado.
- É usado como antisséptico em soluções como tintura de iodo para desinfetar feridas.
- Excesso de iodo pode causar hipertireoidismo, enquanto sua falta provoca hipotireoidismo e bócio.
- Foi descoberto em 1811 por Bernard Courtois.
- É adicionado ao sal de cozinha como medida de saúde pública para prevenir deficiências.
O que é iodo?
O iodo é um elemento químico de símbolo I e número atômico 53, pertencente ao grupo dos halogênios na Tabela Periódica. Ele é um sólido de cor violeta-escura em temperatura ambiente e se sublima facilmente, ou seja, passa do estado sólido diretamente para o gasoso. Na natureza, ele é encontrado principalmente em sais minerais, como o iodeto, e também é adicionado ao sal de cozinha para prevenir deficiências nutricionais.
Para que serve o iodo?
O iodo é essencial para a produção dos hormônios tireoidianos, que regulam o metabolismo do corpo, controlando funções como o crescimento, desenvolvimento e o equilíbrio energético. Sem ele, a glândula tireoide não consegue produzir esses hormônios de maneira adequada, o que pode levar a problemas como o bócio (inchaço da tireoide) e o hipotireoidismo, que afeta o metabolismo. Além disso, ele também é utilizado como antisséptico em soluções como o “iodo povidona”, aplicado para desinfetar cortes e feridas na pele, prevenindo infecções.
Características do iodo

O iodo apresenta algumas características físicas específicas, como ser um sólido de cor violeta-escura ou preta em temperatura ambiente, com um brilho metálico. Uma de suas principais propriedades é a sublimação, ou seja, ele passa diretamente do estado sólido para o gasoso quando aquecido, liberando vapores violeta.
É um elemento relativamente pesado, pouco solúvel em água, mas se dissolve bem em solventes como álcool e éter. Quimicamente, ele é menos reativo que outros halogênios, como o cloro e o flúor, mas ainda assim forma compostos importantes, como os iodetos.
Acesse também: Cloro — importante elemento químico que possui grande poder de desinfecção
Propriedades do iodo
- Símbolo: I.
- Massa atômica: 126,90 u.
- Número atômico: 53.
- Configuração eletrônica: 4d10 5s2 5p5.
- Eletronegatividade: 2,66 (na escala Pauling).
- Série química: halogênios.
- Ponto de fusão: 113,7°C.
- Ponto de ebulição: 184,3°C.
- Energia de ionização: 1.008 kJ/mol (primeira ionização).
- Afinidade eletrônica: 295,2 kJ/mol.
- Densidade: 4,93 g/cm³.
- Dureza (escala de Mohs): 0,4.
- Estado de oxidação: -1, +1, +3, +5, +7.
- Raio atômico (van der Waals): 198 pm.
Obtenção do iodo
A obtenção do iodo geralmente ocorre por meio de fontes naturais, como água do mar, algas marinhas e depósitos de sal-gema. Nesse sentido, o processo mais comum é feito a partir da água salgada ou de salmouras, onde o iodo está presente na forma de iodeto. Sendo assim, primeiramente, as salmouras são tratadas com cloro, que oxida o iodeto (I⁻) a iodo molecular (I2). Esse iodo molecular é então extraído por meio de sublimação ou usando solventes.

Ademais, ele também pode ser recuperado a partir de cinzas de algas marinhas, que são aquecidas para liberar o elemento. Contudo, apesar de esse método ter sido tradicionalmente usado, hoje é menos comum.
Efeitos do iodo no organismo
O iodo tem um papel crucial no organismo, especialmente para a produção de hormônios pela glândula tireoide. Todavia, tanto o excesso quanto a falta dele podem causar problemas de saúde. Diante disso, pontuamos a seguir quais são os efeitos do iodo no organismo.
- Excesso de iodo: quando há muito iodo no organismo, levando à disfunção da tireoide. Isso pode resultar em hipertireoidismo, no qual a tireoide produz hormônios em excesso, causando sintomas como perda de peso, irritabilidade, batimentos cardíacos acelerados e tremores. Em casos extremos, o excesso desse elemento pode até causar inflamações ou bloqueio do funcionamento da tireoide.
- Falta de iodo: já a deficiência de iodo provoca o hipotireoidismo, no qual a tireoide não consegue produzir hormônios suficientes, o que pode causar o bócio (inchaço da tireoide), ganho de peso, cansaço extremo e até problemas no desenvolvimento intelectual em crianças. Durante a gravidez, a falta de iodo pode afetar o desenvolvimento do sistema nervoso do bebê.
Alimentos com iodo

Alimentos ricos em iodo são essenciais para o bom funcionamento da tireoide e para manter o metabolismo equilibrado. Em vista disso, podemos pontuar os principais:
- Frutos do mar: peixes de água salgada, como bacalhau, atum e sardinha, além de mariscos e camarões, são excelentes fontes de iodo.
- Algas marinhas: algumas variedades, como a alga nori e a kelp, são especialmente ricas em iodo, oferecendo uma quantidade muito alta em pequenas porções.
- Laticínios: leite, queijo e iogurte contêm iodo, já que o elemento pode ser encontrado na alimentação das vacas ou ser adicionado durante o processamento.
- Ovos: principalmente a gema, é uma boa fonte de iodo.
- Sal iodado: no Brasil e em muitos outros países, o sal de cozinha é enriquecido com iodo para prevenir deficiências na população.
Veja também: Manganês — outro elemento químico fundamental na manutenção da saúde dos seres humanos
Tintura de iodo
A tintura de iodo é uma solução líquida usada como antisséptico para desinfetar cortes, feridas e a pele antes de procedimentos médicos. Ela contém iodo dissolvido em álcool ou água e é eficaz para eliminar bactérias, fungos e outros microrganismos, ajudando a prevenir infecções. Nesse contexto, seu uso é externo, e, ao aplicar, pode causar uma leve sensação de ardor. Também vale lembrar que esse tipo de tintura é bastante prático para primeiros socorros e pequenas lesões conforme é mostrado a seguir.
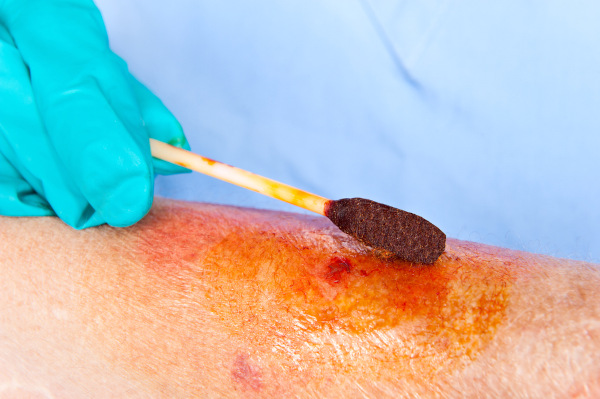
Precauções com o iodo
É importante ter algumas precauções com o uso de iodo, sobretudo em formas como tintura, a qual exige alguns cuidados para garantir a segurança, por exemplo:
- A tintura de iodo deve ser aplicada apenas na pele e nunca ingerida, pois pode ser tóxica se consumida.
- Algumas pessoas podem ser alérgicas ao iodo. Portanto, antes de usar, é importante fazer um teste em uma pequena área da pele para evitar reações alérgicas, como coceira, vermelhidão ou inchaço.
- O uso prolongado ou exagerado na pele pode causar irritação ou até danos. Logo, deve-se aplicar apenas o necessário e em áreas pequenas.
- Para cortes ou feridas muito grandes, o uso de iodo deve ser evitado, pois pode retardar a cicatrização ou causar irritação.
- No caso de uso de suplementos de iodo, é importante não exagerar, porquanto o seu excesso pode desregular a tireoide. Por isso, sempre consulte um médico antes de tomar suplementos, especialmente se houver histórico de problemas na tireoide.
História do iodo
A história do iodo tem início em 1811, quando o químico francês Bernard Courtois o descobriu acidentalmente, pois ele estava trabalhando com algas marinhas para produzir salitre, um componente da pólvora. Ao adicionar ácido sulfúrico às cinzas das algas, percebeu a formação de vapores violetas que, ao se condensarem, geraram cristais escuros. Posteriormente, foram identificados como um novo elemento químico: o iodo.
Entretanto, Courtois não tinha muitos recursos para continuar suas pesquisas, então outros cientistas, como Joseph Louis Gay-Lussac e Humphry Davy, investigaram o elemento mais a fundo e confirmaram que se tratava de um novo elemento químico, ao qual deram o nome de “iodo”, derivado do grego “iodes”, que significa “violeta”, por causa da cor de seus vapores.
Com o tempo, descobriu-se a importância desse elemento para a saúde, sobretudo no tratamento do bócio, uma condição causada pela falta de iodo. Já no século XX, muitos países começaram a adicionar iodo ao sal de cozinha para prevenir deficiências na população, uma medida de saúde pública que continua até hoje.
Fontes
ANDERSSON, M.; BRAEGGER, C. P. The Role of Iodine for Thyroid Function in Lactating Women and Infants. Endocrine Reviews, v. 43, n. 3, p. 469–506, 12 maio 2022.
HATCH-MCCHESNEY, A.; LIEBERMAN, H. R. Iodine and Iodine Deficiency: A Comprehensive Review of a Re-Emerging Issue. Nutrients, v. 14, n. 17, p. 3474, 24 ago. 2022.
KRELA-KAŹMIERCZAK, I. et al. Is There an Ideal Diet to Protect against Iodine Deficiency? Nutrients, v. 13, n. 2, p. 513, 4 fev. 2021.
LISCO, G. et al. Iodine Deficiency and Iodine Prophylaxis: An Overview and Update. Nutrients, v. 15, n. 4, p. 1004, 16 fev. 2023.
NATIONAL CENTER FOR BIOTECHNOLOGY INFORMATION. PubChem. Element Summary for AtomicNumber 53, Iodine. [S.l.]. National Library of Medicine (US), National Center for Biotechnology Information, 2024. Disponível em: https://pubchem.ncbi.nlm.nih.gov/element/Iodine. Acesso em: 2 out. 2024.
NIE, J. et al. Relationship between iodine knowledge and dietary iodine intake in pregnant and lactating women: a cross-sectional study. Public Health Nutrition, v. 26, n. 7, p. 1436–1450, 22 jul. 2023.
RIGUTTO-FAREBROTHER, J. Optimizing Growth: The Case for Iodine. Nutrients, v. 15, n. 4, p. 814, 5 fev. 2023.
SMYTH, P. P. A. Iodine, Seaweed, and the Thyroid. European Thyroid Journal, v. 10, n. 2, p. 101–108, 2021.
SORRENTI, S. et al. Iodine: Its Role in Thyroid Hormone Biosynthesis and Beyond. Nutrients, v. 13, n. 12, p. 4469, 14 dez. 2021.
WELLER, M. et al. Os elementos do grupo 17. In: Química Inorgânica. 6. ed. Porto Alegre: Bookman, 2017. p. 456–475.
WINDER, M. et al. The Impact of Iodine Concentration Disorders on Health and Cancer. Nutrients, v. 14, n. 11, p. 2209, 26 maio 2022.

