Análise volumétrica ou volumetria é um procedimento laboratorial em que utilizamos certo volume de uma solução de concentração conhecida para determinar a concentração de outra solução. O volume da solução de concentração conhecida será determinado quando ela reagir completamente com a solução de concentração desconhecida, ou seja, as soluções envolvidas devem reagir entre si.
Os instrumentos mais utilizados para medir um determinado volume são:
- Pipeta

Exemplo de pipeta utilizada na medição do volume
- Bureta

A bureta é um importante equipamento de medida volumétrica
A medida do volume é feita pela avaliação da altura do chamado menisco, que nada mais é do que a região superficial do líquido que apresenta aspecto retangular ou abaulado (formato de gota), a depender da espessura do recipiente. Quanto mais largo for o recipiente, mais retangular será o menisco; quanto mais fino for o recipiente, mais abaulado ele será. Para avaliar o menisco, o olho deve estar exatamente na sua altura e devemos utilizar como referência a região de baixo, se o menisco for retangular, ou a ponta, se abaulado. Veja uma representação de uma avaliação:
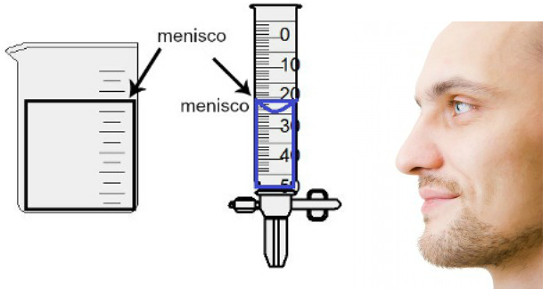
Para avaliar um menisco, é importante que os olhos estejam na direção dele
Na análise volumétrica, o equipamento mais utilizado é a bureta. Isso acontece porque, como o método envolve reações químicas e estas podem processar-se de forma rápida, a bureta permite que o líquido seja liberado em sua ponta em gotas, o que possibilita que interrompamos a saída do líquido de forma mais controlada.
Um dos procedimentos mais utilizados dentro da volumetria é a titulação. Trata-se de uma análise volumétrica que envolve a ocorrência de uma reação entre um ácido e uma base ou vice-versa. Os equipamentos necessários para a sua realização estão representados na imagem a seguir:
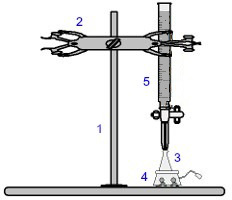
Representação da aparelhagem utilizada em uma titulação
Os números em azul significam:
1) Suporte universal;
2) Garra (utilizada para segurar a bureta);
3) Erlenmeyer (recebe a solução de concentração desconhecida);
4) Agitador magnético (utilizado para agitar a solução presente no erlenmeyer);
5) Bureta (recebe a solução de concentração conhecida).
Ao erlenmeyer é adicionado um volume da solução de concentração desconhecida com o indicador fenolftaleína (imediatamente a solução ficará rosa). Na bureta, é colocado certo volume da solução de concentração conhecida. Em seguida, a solução ácida da bureta é diretamente gotejada na solução básica no erlenmeyer. Esse gotejamento dura até que a solução básica torne-se incolor, momento o qual chamamos de ponto de viragem, que indica que toda a base presente na solução reagiu completamente com o ácido.
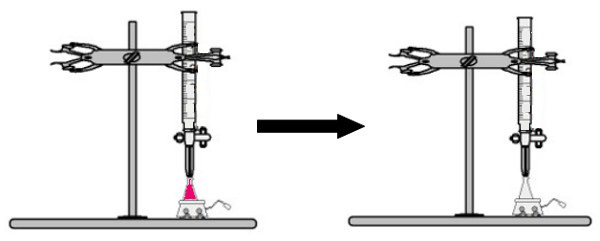
No ponto de viragem, a solução deixa de ser rosa e passa a ser incolor
Observação: Se a solução de concentração desconhecida for a do ácido, quando ela receber o indicador fenolftaleína, ficará incolor. Assim, o ponto de viragem na titulação acontecerá quando a solução ácida ficar rosa ao receber a solução básica da bureta.
Por fim, para determinar a concentração da solução básica, basta utilizar a seguinte equação:
Ma.Va = Mb.Vb
Ma = molaridade do ácido;
Va = volume do ácido;
Mb = molaridade da base;
Vb = volume da base.
Acompanhe agora um exemplo de como é realizado o cálculo de uma solução que apresenta molaridade desconhecida.
1º) 30 mL de uma solução de base desconhecida foi adicionada a um erlenmeyer com o objetivo de realizar uma titulação para determinar sua concentração (molaridade). Na bureta foram adicionados 50 mL de uma solução de ácido de concentração 0,2 mol/L. Após o gotejamento da solução ácida e até que a solução básica fosse titulada, observou-se que foram utilizados 20 mL da solução ácida na titulação. Determine a molaridade da solução básica utilizada.
Dados do exercício:
Vb = 30 mL
Mb = ?
Ma = 0,2 mol/L
Va = 20 mL
Como a molaridade do ácido e seu volume são, respectivamente, 0,2 mol/L e 20 mL, e o volume da base utilizada é de 30 mL, basta utilizar a fórmula da titulação:
Ma.Va = Mb.Vb
0,2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol/L
Por Me. Diogo Lopes Dias
