Os óxidos são uma função inorgânica cujos compostos são binários, isto é, possuem apenas dois elementos constituintes, sendo que o mais eletronegativo deles é o oxigênio. Os óxidos ácidos são aqueles óxidos que quando reagem com a água produzem um ácido.
A emissão de óxidos ácidos para a atmosfera vem crescendo cada vez mais nas últimas décadas. Eles podem ser emitidos através de fontes naturais, tais como a respiração vegetal e animal, erupções vulcânicas e decomposição de restos vegetais e animais. No entanto, o fator agravante é que alguns óxidos ácidos são liberados também na combustão de combustíveis fósseis, como os derivados do petróleo (gasolina, óleo diesel etc.).
Quando esses óxidos se encontram na atmosfera, eles reagem com a água da chuva e a tornam ácida. O pH normal da água é de 7,0 (neutra). Valores menores que este indicam soluções ácidas.
É bem verdade que toda chuva carrega consigo impurezas presentes na atmosfera, não sendo totalmente pura. Além disso, é normal certa quantidade desses óxidos estar na atmosfera. Porém, com o aumento cada vez maior do uso dos combustíveis fósseis, as concentrações dessas substâncias têm se tornado alarmantes.
O gás carbônico (dióxido de carbono – CO2) é um exemplo de óxido ácido que reage com a água da chuva, conforme a reação abaixo, e forma o ácido carbônico:
1 CO2(g) + 1 H2O(l)→ 1 H2CO3(aq)
Esse ácido é fraco e, por isso, esse tipo de chuva não é considerado nocivo.

Algo semelhante ocorre com os óxidos de nitrogênio (NOx), entre os quais o principal é o dióxido de nitrogênio (NO2). Ele reage com a água formando o ácido nitroso (HNO2) e o ácido nítrico (HNO3):
2 NO2(g) + 1 H2O(l)→ 1 HNO2(aq) + 1 HNO3(aq)
Apesar desse tipo de chuva ácida não ser considerado nocivo, em longo prazo, pode causar certo impacto ambiental.
Tópicos deste artigo
Mapa Mental: Chuva Ácida
.jpeg)
*Baixe o mapa mental sobre chuva ácida!
Porém, os óxidos ácidos mais perigosos, por formarem uma chuva ácida mais forte, são os óxidos de enxofre (SO2 e SO3). Esses compostos reagem com a água e formam o ácido sulfúrico (H2SO4).
1 S(s) + 1 O2(g) → 1 SO2(g)
1 SO2(g) + 1 H2O(l)→ 1 H2SO3(aq) (Ácido sulfuroso)
1 SO2(g)+ ½ O2(g) → 1 SO3(g)
1 SO3(g) + 1 H2O(l)→ 1 H2SO4(aq) (Ácido sulfúrico)
O ácido sulfúrico é o principal vilão da chuva ácida, pois ele é um ácido muito forte.
Tecnicamente, são chamadas de chuvas ácidas as que possuem pH menor que 5,6.
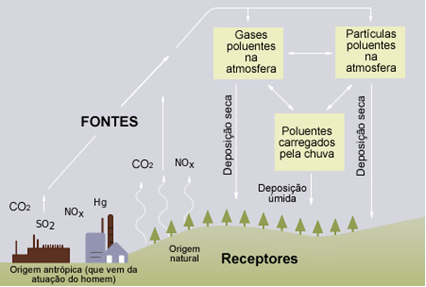
A chuva ácida degrada monumentos artísticos, estátuas, construções, estruturas metálicas de casas, edifícios e pontes, destrói plantações e árvores, envenena solos, rios e águas subterrâneas, causando morte em muitos animais.

Por Jennifer Fogaça
Graduada em Química
