Os óxidos básicos são aqueles que ao reagirem com a água dão origem a bases. Já quando reagem com um ácido dão origem a sal e água.
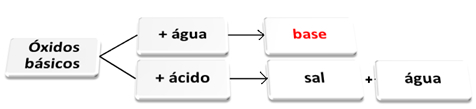
Óxidos básicos reagindo com água e com ácido.
Por exemplo, temos o óxido de sódio (Na2O), que é um óxido básico. Veja a seguir que, ao reagir com a água, ele forma a base hidróxido de sódio:
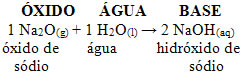
Se esse mesmo óxido reagir com um ácido, como o ácido sulfúrico (H2SO4), será produzido um sal (sulfato de sódio) e a água.
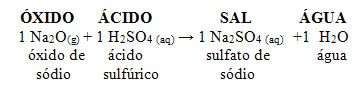
Se um óxido básico reagir com um óxido ácido, também se produz um sal, porém sem a água.
Conforme o exemplo mostrado, os outros óxidos básicos também são compostos iônicos, sendo formados na sua maioria por metais, elementos que são altamente eletropositivos, apresentando normalmente a “carga” igual a +1 ou +2.
Exemplos:
Na2O = Na1+
K2O = K1+
CaO = Ca2+
MgO = Mg2+
Esses compostos apresentam pontos de fusão e ebulição elevados e todos encerram o ânion oxigênio (O2-).
Aplicações de alguns óxidos básicos:
• CaO: Óxido de cálcio
Esse composto é normalmente conhecido como cal virgem. Ao reagir com a água, conforme a reação a seguir, forma-se uma base (hidróxido de cálcio) que é usada para pintar paredes, troncos de árvores e outros materiais, com a principal finalidade de repelir insetos, preservar a vedação e evitar a infiltração da água. Essa base formada é chamada de cal hidratada e, por isso, quando se pinta com ela, dá-se o nome de pintura de caiação.
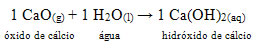

Pintura de caiação.
• K2O: Óxido de potássio
O óxido de potássio é normalmente encontrado em cinzas de madeira e de cigarros. Ao reagir com água, ele forma a base hidróxido de potássio (KOH), utilizada na fabricação de sabões. Inclusive, antigamente, em locais onde não havia o KOH, usavam-se cinzas vegetais, que continham K2O, para reagir com gorduras e produzir o chamado “sabão de cinza”.
Por Jennifer Fogaça
Graduada em Química

