Os óxidos anfóteros são óxidos que possuem um comportamento ambíguo, pois frente a um ácido eles se comportam como um óxido básico; e na presença de uma base se comportam como óxidos ácidos.
Tanto a base como o ácido com o qual os óxidos anfóteros reagem devem ser fortes, com caráter químico bem pronunciado.
Os óxidos anfóteros são, em geral, sólidos iônicos, pouco solúveis em água e, ao reagirem com esses ácidos e bases fortes, produzem água e sal.
De modo geral, temos:
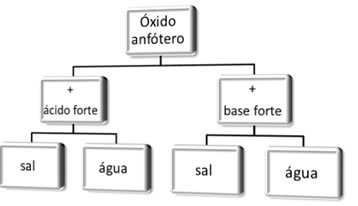
Esquema de reações de óxidos anfóteros.
A seguir temos reações envolvendo dois óxidos anfóteros, o óxido de zinco (ZnO) e o óxido de alumínio (Al2O3). Observe como em determinadas situações eles reagem como ácidos e em outras eles se apresentam como bases:
1º Caso: ao reagirem com ácidos fortes: comportam-se como óxidos básicos, produzindo sal e água
Óxido Ácido Sal Água
Anfótero forte
(base)
ZnO(s) + H2SO4(aq) → ZnSO4(aq) + H2O(l)
Al2O3(s) + 6 HCl(aq) → 2 AlCl3(aq) + 3 H2O(l)
2º Caso: ao reagirem com bases fortes: comportam-se como óxidos ácidos, produzindo sal e água
Óxido Base Sal Água
anfótero forte
(ácido)
ZnO(s) + 2NaOH(aq) → Na2ZnO2(aq) + H2O(l)
Al2O3(s) + 2 KOH(aq) → 2 KAlO2(aq) + H2O(l)
Os óxidos anfóteros principais são de zinco e de alumínio; inclusive o óxido de zinco (ZnO), também conhecido como alvaide, é um pó branco, amorfo, inodoro, insolúvel em água, mas solúvel em soluções ácidas, que é usado na pintura de rostos de palhaços. Ele também é usado como adstrigente e protetor solar nas formas de loção, unguento e gelatina.

Palhaço passando alvaiade (óxido de zinco) como maquiagem
Existem também óxidos de outros metais (SnO e SnO2, PbO e PbO2) e de ametais (As2O3, As2O5, Sb2O3, Sb2O3).
Por Jennifer Fogaça
Graduada em Química

