Os óxidos ácidos são aqueles óxidos que ao reagirem com a água produzem um ácido como produto. Já ao reagir com uma base, os produtos serão sal e água.
Esses compostos normalmente apresentam caráter covalente, isto é, são moleculares, sendo solúveis em água e formados em sua maioria por ametais, que são elementos com alta eletronegatividade. Quando formados por metais, esses possuem números de oxidação (carga elétrica) elevados.
Exemplos:
CO2, SO2, SO3, P2O5, Cl2O6, NO2, N2O4, N2O5, etc.
A seguir temos o esquema geral das reações características para os óxidos ácidos e um exemplo:
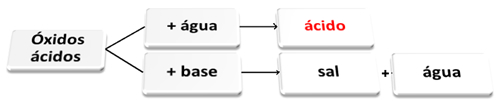
Óxidos ácidos reagindo com água e com base
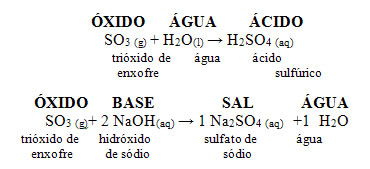
Os óxidos ácidos também são denominados anidridos, porque essa palavra vem do grego anhydros, que significa “sem água”, e os óxidos ácidos podem ser considerados um “ácido sem água”.
Propriedades e aplicações de alguns óxidos ácidos:
• Dióxido de carbono (gás carbônico) – CO2:
Esse composto é utilizado como gás de refrigerantes e em águas minerais, pois quando submetido a altas pressões, torna-se solúvel em água. Ele produz nesses produtos um meio ácido, pois é um óxido ácido que reage com a água, produzindo um ácido, conforme a reação abaixo:
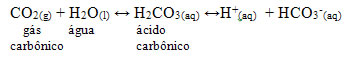
Abaixo de 78ºC, ele se encontra no estado sólido e é conhecido como gelo-seco, que recebe esse nome porque seu aspecto lembra o gelo comum, porém ele não se derrete, passando para o estado líquido em temperatura ambiente, mas passa para o estado de vapor, ou seja, ele sublima. Assim, essa característica é usada como recurso cênico em shows, filmes, teatros, festas, etc.

O gás carbônico é um óxido ácido
Ele também é encontrado na atmosfera, como resultado da respiração humana, da queima de combustíveis fósseis (carvão, derivados do petróleo, álcool, etc.) e queimadas de florestas. Assim, ele é um dos responsáveis pela chuva ácida.
• Óxidos de enxofre – SO2 e SO3
Esses óxidos também estão presentes na atmosfera, sendo de origem natural e artificial. A natural se dá por meio das erupções vulcânicas e da decomposição de vegetais e animais. Já a artificial corresponde à maior parcela de quantidade desses óxidos na atmosfera, pois são expelidos pela queima de combustíveis fósseis, principalmente o óleo diesel, que contém enxofre como impureza.
O dióxido de enxofre (SO2) reage com o oxigênio da atmosfera produzindo o trióxido de enxofre (SO3). Ao reagir esse último óxido com a água da chuva, forma-se o ácido sulfúrico, que é muito forte e causa estragos.
• Queima do enxofre dos combustíveis: S + O2 → SO2
• Transformação de SO2 em SO3: SO2 + ½ O2 → SO3
Reações de SO2 e SO3 com água originando ácidos: SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
• Tetróxidos de dinitrogênio (anidrido nitroso-nítrico) – N2O4
Esse composto tem ponto de ebulição igual a 22ºC, possui coloração amarela e é bastante volátil. É formado na atmosfera pela oxidação do nitrogênio e pode apresentar-se na forma líquida, na forma de um dímero do dióxido de mononitrogênio ou óxido nítrico (NO2). Acima dessa temperatura, adquire a forma do NO2:
N2O4 ↔ NO2
É um gás extremamente tóxico, sendo sua inalação fatal. É também usado na composição de combustíveis para foguetes.
Por Jennifer Fogaça
Graduada em Química

