Os óxidos são compostos formados por dois elementos diferentes, sendo que um deles é o oxigênio, que precisa ser o mais eletronegativo entre os dois.
A nomenclatura dos óxidos inorgânicos segue regras que dependem se o óxido é molecular, de rede covalente ou iônico. Vejamos cada caso:
* Nomenclatura dos óxidos moleculares ou de rede covalente:
Os óxidos moleculares ou de rede covalente são aqueles que possuem o oxigênio ligado a um ametal, tais como o carbono (C), o nitrogênio (N), o enxofre (S), o flúor (F), entre outros. A nomenclatura desses óxidos segue a seguinte regra:

Regra de nomenclatura dos óxidos formados com ametais
O prefixo mono na frente do elemento ligado ao oxigênio é opcional.
Por exemplo, temos o seguinte óxido molecular: CO.
- Prefixo que indica a quantidade de oxigênios: 1 oxigênio: mono;
- óxido de;
- Prefixo que indica a quantidade de átomos do outro elemento: 1 carbono: mono;
- Nome do elemento ligado ao oxigênio: carbono.
Assim, seu nome fica da seguinte forma: CO = Monóxido de monocarbono ou monóxido de carbono.
Veja mais exemplos:
Dióxido de carbono - CO2
Trióxido de enxofre - SO3
Heptóxido de Dicloro - Cl2O7
Monóxido de dinitrogênio - N2O
Trióxido de dinitrogênio - N2O3
Monóxido de nitrogênio -NO
Dióxido de nitrogênio - NO2
Pentóxido de dinitrogênio - N2O5
Dióxido de silício - SiO2
Pentóxido de difósforo - P2O5
Trióxido de enxofre - SO3
* Nomenclatura dos óxidos iônicos:
Os óxidos iônicos são aqueles que possuem o oxigênio ligado a um metal, tais como o ferro (Fe), o chumbo (Pb), o sódio (Na), o cálcio (Ca), a prata (Ag), entre outros. Geralmente, a carga elétrica do oxigênio é -2.
A nomenclatura mencionada para os óxidos moleculares ou de rede covalente também é aplicada atualmente para os óxidos metálicos e é a considerada como oficial. Veja alguns exemplos:
Monóxido de ferro - FeO
Monóxido de chumbo – PbO
Dióxido de chumbo - PbO2
Trióxido de diferro - Fe2O3
No entanto, existe uma nomenclatura específica para os óxidos metálicos que ainda é muito usada. Ela baseia-se na valência do elemento ligado ao oxigênio.
Se o elemento tiver uma única valência, ou seja, se houver somente uma forma de ligar-se ao oxigênio e formar somente um tipo de óxido, a regra de nomenclatura será dada por:

Regra de nomenclatura de óxidos iônicos com uma única valência
Exemplos:
- Óxido de sódio - Na2O
- Óxido de cálcio - CaO
- Óxido de potássio - K2O
- Óxido de alumínio - Al2O3
- Óxido de prata – Ag2O
Mas existem também óxidos iônico formados por elementos com mais de uma valência. Nesses casos, a regra de nomenclatura é a seguinte:
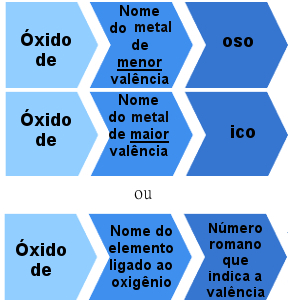
Regra de nomenclatura de óxidos iônicos com mais de uma valência
Exemplos:
Óxido ferroso - FeO
Óxido férrico - Fe2O3
Óxido cuproso - Cu2O
Óxido cúprico – CuO
Ou:
Óxido de ferro II - FeO (Nox do ferro = +2)
Óxido de ferro III - Fe2O3 (Nox do ferro = +3).
Óxido de cobre I - Cu2O (Nox do ferro = +1)
Óxido de cobre II - CuO (Nox do ferro = +2).
Por Jennifer Fogaça
Graduada em Química