A titulação é um procedimento laboratorial utilizado para determinar a concentração em quantidade de matéria (ou concentração em mol/L) de uma solução que contém um ácido ou uma base.
Durante a titulação, sempre ocorre uma mistura de soluções contendo solutos diferentes com ocorrência de reação química. Como as soluções misturadas apresentam sempre um ácido e uma base, logo, a reação química que ocorre é uma neutralização.
![]()
Equação química que representa uma titulação.
O processo para determinar a concentração molar de uma solução desconhecida durante a titulação depende dos seguintes fatores:
• Conhecer a concentração molar da solução que será misturada à desconhecida;
• Conhecer o volume da solução de concentração desconhecida;
• Conhecer o volume da solução de concentração conhecida.
Fórmula utilizada em uma titulação
Como na titulação ocorre uma neutralização (igualdade entre o número de mol do ácido e o da base), podemos utilizar a seguinte fórmula para determinar a concentração molar da solução desconhecida:
na = nb
Ma.Va = Mb.Vb
Obs.: O número de mol é o produto entre a concentração molar (M) e o volume de uma solução (V).
Equipamentos necessários para realizar uma titulação
• Bureta: equipamento utilizado para medir o volume da solução de concentração conhecida;
![]()
• Erlenmeyer: equipamento utilizado para receber a solução de concentração desconhecida;
• Suporte universal: equipamento no qual a garra é fixada;

• Garra: equipamento utilizado para prender a bureta;
![]()
• Agitador magnético: equipamento utilizado para agitar a solução presente no erlenmeyer.

Etapas de uma titulação
- 1ª Etapa: fixar a bureta no suporte universal por meio da utilização da garra;
- 2ª Etapa: posicionar o erlenmeyer sobre o agitador magnético;
- 3ª Etapa: adicionar um determinado volume, no interior do erlenmeyer, da solução de concentração desconhecida. Por exemplo: adicionar 10 mL da solução no erlenmeyer;
- 4ª Etapa: adicionar fenolftaleína na solução presente no erlenmeyer.
Obs.: Se a solução que estiver no erlenmeyer for ácida, ao adicionar a fenolftaleína, a solução permanecerá com a cor inalterada, porém, se a solução for básica, ficará com a coloração rosa avermelhado.

Fenolftaleína adicionada a uma solução de característica básica.
- 5ª Etapa: adicionar uma barra magnética no interior do erlenmeyer. Em seguida, ligar o agitador magnético para que o líquido no interior do erlenmeyer passa ser agitado;
- 6ª Etapa: adicionar no interior da bureta, até a sua capacidade máxima, um volume de uma solução de concentração conhecida, ou seja, se a bureta for de 50 mL, adicionar 50 mL dessa solução.
- 7ª Etapa: abrir a válvula da bureta e permitir que o líquido de seu interior caia no erlenmeyer.
Observações realizadas durante a titulação
A partir do momento que a bureta é aberta sobre o erlenmeyer, começa a ocorrer a reação de neutralização, ou seja, o ácido reage com a base, formando sal e água gradativamente.
À medida que a reação de neutralização vai ocorrendo com a mistura, a coloração da solução presente no erlenmeyer também vai mudando gradativamente, o que denominamos de ponto de viragem, da seguinte forma:
- Se estava incolor, começa a ficar rosa avermelhado,
- Se estava rosa avermelhado, começa a ficar incolor.
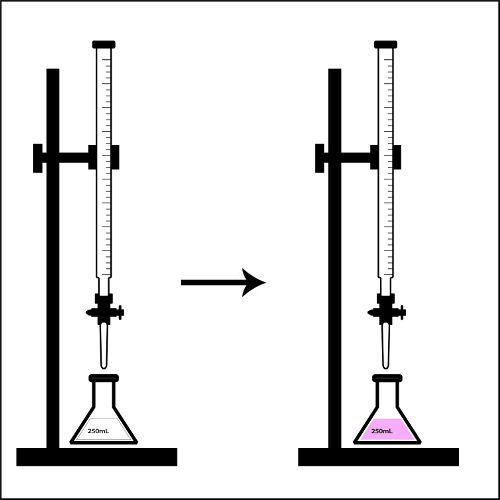
Representação do ponto de viragem em uma titulação.
Quando a solução presente no erlenmeyer muda totalmente de cor, ou seja, atingiu o ponto de viragem, dizemos que a titulação acabou. Nesse momento, basta verificar na bureta o volume utilizado da solução de concentração conhecida que ali estava.
A partir da soma entre o volume da solução de concentração conhecida, que foi determinado na bureta, e volume da solução desconhecida, que estava o erlenmeyer, temos a condição de determinar sua concentração molar.
Por Me. Diogo Lopes Dias
