PUBLICIDADE
A capacidade que as ligações possuem de atrair cargas elétricas se define como Polaridade, esta assume caráter diferente dependendo da ligação onde se faz presente.
As ligações mais frequentes envolvendo compostos orgânicos acontecem entre átomos de carbono ou entre átomos de carbono e hidrogênio: C ─ C e C ─ H (hidrocarbonetos). Classificamos este tipo de ligação como covalente, ela está presente em todas as ligações dos compostos orgânicos formados somente por carbono e hidrogênio.
Quando na molécula de um composto orgânico houver outro elemento químico além de carbono e hidrogênio, suas moléculas passarão a apresentar certa polaridade. Chamamos este elemento de heteroátomo e pode ser: nitrogênio (N), oxigênio (O), entre outros.
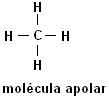
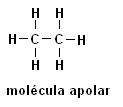
Metano (CH4) Etano (C2H6)
Repare que em ambas as estruturas não há presença de heteroátomos, neste caso as moléculas se classificam como apolares.
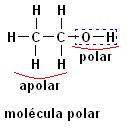
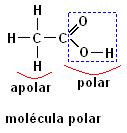
A presença do Oxigênio como heteroátomo faz as moléculas apresentarem polaridade. A primeira molécula se trata do composto Etanol (CH3CH2OH), a presença da hidroxila – OH dá a este composto o caráter polar, mesmo que em sua estrutura contenha uma parte apolar.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Veja mais! Isomeria plana






