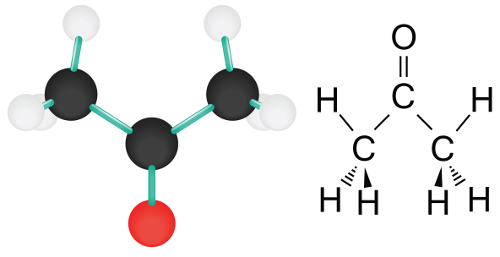
As reações de oxidação com álcoois secundários são aquelas nas quais ocorre a interação entre um composto orgânico do grupo dos álcoois, que deve ser secundário, e o chamado reagente de Bayer (KMnO4) em meio ácido.
Sempre que o reagente de Bayer está em meio ácido (aq/H+), ele sofre uma reação de decomposição, originando óxido de potássio, óxido de manganês II e oxigênios nascentes, como podemos observar na equação a seguir:
2 KmnO4(aq/H+) → 2 MnO + K2O + 5 [O]
Em uma reação de oxidação qualquer, os oxigênios nascentes, originados a partir da decomposição do permanganato de potássio em meio ácido, atacam as cadeias carbônicas que possuem ligações pi entre carbonos (alcenos, alcinos e alcadienos) ou que são fechadas (ciclanos, ciclenos earomáticos), gerando novos compostos químicos.
No caso da reação de oxidação em álcoois secundários, antes de entendermos o mecanismo reacional, é necessário relembrar o conceito de um álcool secundário. Denomina-se de álcool secundário aquele em que a hidroxila (OH) encontra-se ligada a um carbono secundário (carbono ligado diretamente a outros dois átomos de carbono). Veja a representação de um álcool secundário:
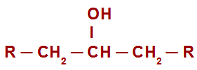
Fórmula estrutural geral de um álcool secundário
Em toda reação de oxidação em álcoois, os oxigênios nascentes atacam os hidrogênios localizados no carbono que apresenta o grupo hidroxila. No caso das reações de oxidação em álcoois secundários, os oxigênios possuem apenas um átomo de hidrogênio para atacar em cada estrutura desse tipo de álcool.
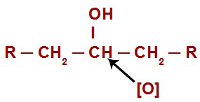
Oxigênios nascentes atacando um álcool secundário
Ao atacar o hidrogênio (H) presente no carbono da hidroxila (OH), o oxigênio nascente ([O]) forma uma nova hidroxila no mesmo carbono. Assim, passamos a ter um diol gemino na cadeia. Como o diol gemino (HO – C – OH) é instável, ocorre sua decomposição em uma molécula de água. Já entre o carbono e o oxigênio que sobra de uma das hidroxilas, há a formação de uma ligação dupla (pi e sigma).
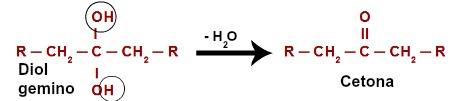
Equação química da oxidação de um álcool secundário
O produto originado a partir de uma reação de oxidação de álcoois secundários sempre é uma cetona, pois a ligação dupla sempre é gerada no carbono secundário, o que resulta em uma carbonila entre dois carbonos, configurando, assim, uma cetona.
Veja agora um exemplo da reação de oxidação em álcoois secundários.
Exemplo: Butan-2-ol
O butan-2-ol é um álcool secundário, já que a hidroxila está ligada a um átomo de carbono secundário. Sendo assim, no carbono que possui a hidroxila, há apenas um hidrogênio. Podemos conferir esse fato na estrutura abaixo:
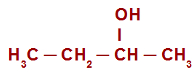
Quando submetido a um meio contendo água, ácido e o KMnO4 (reagente de Bayer), o seu hidrogênio é atacado por um oxigênio nascente, transformando-se em uma nova hidroxila, o que resulta em um diol gemino.
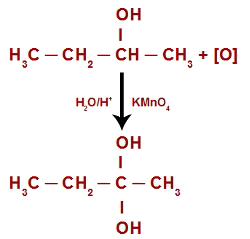
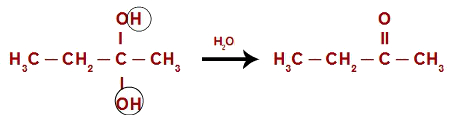
Por fim, ocorre uma decomposição das duas hidroxilas presentes no diol gemino, resultando, assim, em uma molécula de água e em uma cetona, em virtude da necessidade da criação de uma ligação entre o carbono e um dos oxigênios das hidroxilas decompostas.
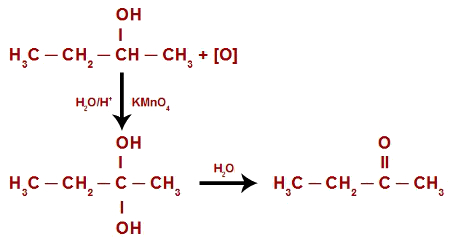
Podemos representar toda a reação da oxidação do butan-2-ol pela seguinte equação:
Por Me. Diogo Lopes Dias