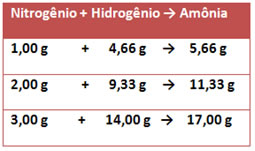
O químico francês Joseph Louis Proust (1754-1826) passou a realizar cuidadosas experiências relacionando as massas dos componentes de determinadas reações.
Por exemplo, os elementos que compõem a água são o hidrogênio e o oxigênio. Proust verificou que nessa reação de formação da água, o hidrogênio sempre reagia com o oxigênio em uma proporção constante e definida, que era de 1:8, respectivamente. Veja como isso ocorre abaixo:
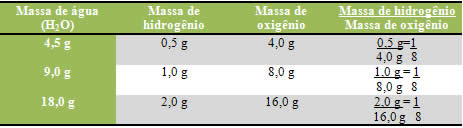
Observe que não importa a quantidade de massa dos elementos usada, a proporção sempre será a mesma.
Proust observou que isso não ocorria somente com a água, mas com todas as outras substâncias.
São formados 15,06 g de sulfeto cúprico (CuS), por exemplo, reagindo 10,00 g de cobre metálico (Cu) com 5,06 g de enxofre (S). Assim, se dobrarmos a quantidade de cobre (que irá para 20,0 g), e se quisermos que todo o cobre reaja, será necessário dobrar também a quantidade do enxofre, para 10,12 g, com a formação total de 30,12 g de sulfeto.
Agora, se for colocada uma quantidade que não esteja em proporção, a quantidade em excesso irá sobrar, não irá reagir. Observe isso a seguir:
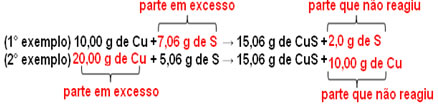
Observe que a reação só ocorre de acordo com a proporção definida. Por isso, em 1799, Proust concluiu que, quando várias substâncias se combinam para formar um composto, isso é sempre feito numa relação de massas definida.
Assim, ele criou uma Lei que é denominada de Lei de Proust, Lei das Proporções Constantes ou Lei das Proporções Definidas, que é enunciada da seguinte maneira:

Essa lei e a Lei de Lavoisier (Lei da Conservação da Massa) são denominadas Leis Ponderais, porque falam em massas das substâncias envolvidas.
Por Jennifer Fogaça
Graduada em Química