Os combustíveis usados na maioria dos automóveis são a gasolina e o etanol. A combustão completa desses dois combustíveis gera dióxido de carbono (CO2(g)) e água (H2O). Infelizmente, porém, a combustão incompleta e as impurezas presentes no álcool e na gasolina podem gerar substâncias bastante poluentes para o meio ambiente. No caso da gasolina, são gerados o monóxido de carbono (CO(g)); hidrocarbonetos (compostos constituídos de carbono e hidrogênio), como o etano (C2H6(g)); e óxidos de nitrogênio (NOx), principalmente o monóxido de nitrogênio (NO) e o dióxido de nitrogênio (NO2(g)).
Assim, para evitar o aumento da poluição atmosférica, todos os carros necessitam de um equipamento denominado conversor catalítico ou catalisador, que é um dispositivo antipoluição, que tem a função de tratar esses gases liberados pelo motor de combustão interna e transformá-los em gases menos nocivos. Os conversores catalíticos também são usados com essa finalidade em alguns processos industriais.
Os gases poluentes citados saem do motor e entram no conversor catalítico, passando por uma espécie de “colmeia”, cujas celas são feitas geralmente de material cerâmico ou metálico, que é revestido de alumina (óxido de alumínio – Al2O3). Esse formato de colmeia, com minúsculos canais, é importante, porque fornece uma grande superfície de contato com os gases, fazendo com que eles reajam mais rapidamente.
Mas o catalisador verdadeiro é um metal que fica sobre o óxido de alumínio. Normalmente os metais usados são o paládio, o ródio, a platina ou o molibdênio. Podem-se misturar também esses metais e se usar ligas. Por exemplo, no caso da gasolina, usa-se normalmente uma liga de paládio e tório; já no caso do etanol, utiliza-se mais uma liga de paládio e molibdênio. Esses metais realizam uma catálise heterogênea com os gases poluentes.
Catálise heterogênea é um tipo de reação em que o catalisador forma com os reagentes (no caso, os gases poluentes) um sistema polifásico. Isso se dá porque o catalisador adsorve, isto é, retém, as moléculas dos reagentes em sua superfície, enfraquecendo suas ligações e fazendo com que a reação se processe de forma mais rápida.
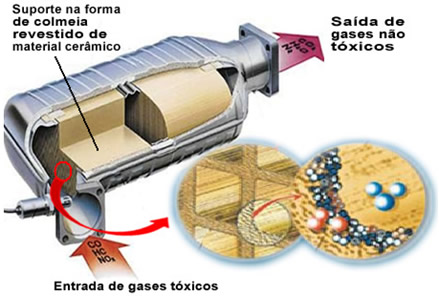
Com isso, os metais catalisadores transformam os agentes poluidores, como o CO e NOx em gases não tóxicos, como CO2, H2O, O2 e N2. Veja algumas dessas reações a seguir e observe que por meio delas há a oxidação dos hidrocarbonetos e do CO (derivados da combustão incompleta) e também a redução dos óxidos de nitrogênio para gás nitrogênio (N2):
2 CO(g) + 2 NO(g) → 2 CO2(g) + 1 N2(g)
2 CO(g) + 1 O2(g) → 2 CO2(g)
2 C2H6(g) + 7 O2(g) →4 CO2(g) + 6 H2O(v)
2 NO2(g) +4 CO(g) →1 N2(g) + 4 CO2(g)
2 NO2(g) →1 N2(g) + 2 O2(g)
2 NO(g) →1 N2(g) + 1 O2(g)
Por Jennifer Fogaça
Graduada em Química
