Leis ponderais são generalizações sobre as massas de todos os participantes (reagentes e produtos) de uma reação química. Genericamente, uma reação química pode ser representada da seguinte forma:
A + B C + D
→ Lei de Lavoisier (Lei da conservação da massa)
De acordo com Lavoisier, quando uma reação química é realizada em ambiente fechado, a soma das massas dos reagentes é sempre igual à soma das massas dos produtos.
Soma das massas dos reagentes = Soma das massas dos produtos
Assim, segundo Lavoisier, se uma reação genérica (reagentes A e B, produtos C e D) for realizada em um recipiente fechado, utilizando-se 5 gramas de A e 10 gramas de B, podemos afirmar que a massa do produto C é de 15 gramas.
A + B → C
5g 10g x
Como a soma das massas dos reagentes é igual à soma das massas dos produtos:
5 + 10 = x
15 gramas = x
ou
x = 15 g
→ Lei de Proust (Lei das proporções definidas)
De acordo com Proust, os participantes de uma reação química sempre estabelecem uma proporção em massa constante. Quando realizamos a decomposição da água por eletrólise, por exemplo, obtemos gás hidrogênio e gás oxigênio:
2H2O → 2H2 + O2
Sempre que isso é feito, verifica-se que a proporção entre as massas dos gases hidrogênio e oxigênio obtidas é sempre de 1 para 8, não importando a massa de água que foi utilizada na eletrólise. Assim:
-
Eletrólise de 4,5 gramas de água
2H2O → 2H2 + O2
4,5g 0,5g 4g
Se dividirmos as massas de H2 e O2 formadas, teremos a proporção 1 para 8:
0,5 = 1
4 8
-
Eletrólise de 9 gramas de água
2H2O → 2H2 + O2
9g 1g 8g
Se dividirmos as massas de H2 e O2 formadas, teremos a proporção 1 para 8:
1
8
Outro fato interessante observado por Proust é que, se dividirmos as massas de H2O, H2 e O2 dos dois exemplos acima, teremos a mesma proporção:
2H2O → 2H2 + O2
4,5g 0,5g 4g
9g 1g 8g
Ou seja:
1 = 1 = 1
2 2 2
Por isso, de acordo com a lei de Proust, para uma reação genérica, utilizando-se diferentes massas das substâncias envolvidas nela, em momentos distintos, podemos utilizar a seguinte expressão com relação às massas dos participantes:
A + B → C
1ª experiência mA = mB = mC
2ª experiência mA’ = mB’ = mC’
→ Lei de Dalton (Lei das proporções múltiplas)
De acordo com John Dalton, quando uma massa fixa de uma substância A combina-se com massas diferentes de uma substância B, originando substâncias diferentes, as massas de B apresentam entre si uma relação expressa por números inteiros e pequenos.
Quando reagimos carbono com oxigênio, por exemplo, podemos formar dióxido de carbono ou monóxido de carbono, como nos dois casos a seguir:
Carbono + oxigênio → dióxido de carbono
12g 16g 28g
Carbono + oxigênio → dióxido de carbono
12g 32g 44g
Temos nas duas reações a mesma massa do reagente A. Assim, se dividirmos as massas de oxigênio, que é a substância B que aparece em ambas as reações, observaremos uma relação entre números inteiros e pequenos:
16 = 1
32 2
→ Aplicação das leis ponderais:
1º) Sabe-se que o gás Hidrogênio reage com o gás Oxigênio na proporção 1:8, em massa, para formar água. Sabendo desse fato, determine os valores das massas X, Y e Z na tabela a seguir, respectivamente:
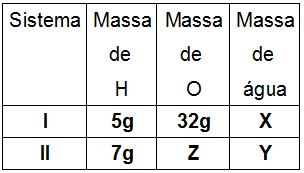
a) 36 g, 44 g e 51,8 g
b) 33,6 g, 2,4 g e 52 g
c) 32 g, 44 g e 51 g
d) 36 g, 48 g e 52 g
e) 37 g, 44,8 g e 51,8 g
Para resolver a questão, basta fazer o seguinte:
1o Passo: A massa X pode ser encontrada pela Lei de Lavoisier, já que é a única massa conhecida na segunda experiência, assim:
Soma das massas dos reagentes = Soma das massas dos produtos
5 + 32 = X
37 = X
X = 37 gramas
2o Passo: Para encontrar o valor da massa Z, podemos utilizar a lei de Proust, pois, em uma reação que é realizada mais de uma vez, as massas seguem uma proporção de acordo com o esquema abaixo:
mA = mB = mC
mA’ mB’ mC’
Assim, para encontrar a massa Z, podemos utilizar os participantes A (Hidrogênio) e B (Oxigênio):
mA = mB
mA’ mB’
5 = 32
7 Z
5.Z = 7.32
Z = 224
5
Z = 44,8 gramas
3o Passo: A massa y pode ser encontrada pela Lei de Lavoisier, assim:
Soma das massas dos reagentes = Soma das massas dos produtos
7 + 44,8 = Y
51,8 = Y
Y = 51,8 gramas
Por Me. Diogo Lopes Dias
