PUBLICIDADE
O estudo dos gases teve início com Torricelli, quando mediu sua pressão e apresentou adequadas explicações sobre o fenômeno.
A primeira pessoa a utilizar o termo gás foi Jean-Baptiste, um naturalista belgo, alquimista e químico.
O termo gás vem do grego caos e significa espaço vazio.
O gás tem como característica principal ocupar totalmente o volume do recipiente que o hospeda, independentemente de sua quantidade.
Isso acontece porque os gases se comportam de forma desordenada em virtude do grau de liberdade que possuem, ocupando totalmente o volume do recipiente a ele oferecido.
Outra característica dos gases é sua grande capacidade de compressão.
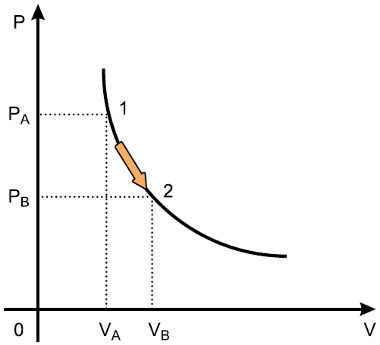
Lei Boyle-Mariotte
Diz que a temperatura de uma amostra de gás permanece constante e sua variação de volume é inversamente proporcional a sua variação da pressão.
pV = a
onde:
p = pressão da amostra
V = volume
a = amostra de gás (depende da temperatura em que ocorre a transformação)
Lei de Charles e Gay-Lussac
Se a pressão da amostra do gás for mantida constante, sua temperatura e volume são diretamente proporcionais.
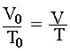
Onde:
V = volume
T = temperatura
Obs.: Essa proporcionalidade volume e temperatura só são válidas para a escala Kelvin.
Lei Geral dos Gases Perfeitos
Procura relacionar em uma transformação de massa gasosa, as variáveis: temperatura, pressão e volume.
É representada pela equação matemática:
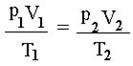
Onde:
p1 = pressão inicial
V1 = volume inicial
T1 = temperatura inicial
p2 = pressão final
V2 = volume final
T2 = temperatura final
Por Talita A. Anjos
Graduada em Física
Equipe Brasil Escola