Difusão e efusão são duas leis propostas pelo químico escocês Thomas Graham, no século XIX, a partir dos seus estudos sobre misturas gasosas e o comportamento dos gases ao atravessar as paredes de um recipiente.
Entre as observações realizadas por Thomas Graham sobre o comportamento dos gases em relação à difusão e efusão, podemos destacar as seguintes:
-
Um gás sempre tem a tendência de atravessar pequenos orifícios presentes em uma matéria no estado sólido;
-
Quanto maior é a massa da molécula do gás, maior é a sua dificuldade de atravessar os orifícios da matéria sólida;
-
Quanto menor é a densidade do gás, maior é a sua velocidade de movimentação;
-
Quanto maior é a temperatura a que um gás é submetido, maior é a velocidade em que ele se espalha no ambiente ou atravessa um orifício;
- Um gás nunca permanece estático em um determinado local.
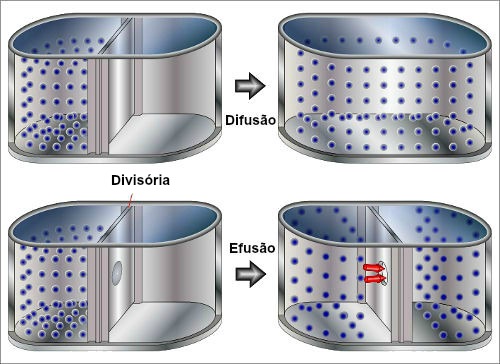
Difusão
Difusão é um fenômeno físico que consiste na capacidade de um gás de se difundir (ou seja, espalhar-se) por todo o espaço de uma área ou dentro de um recipiente. Por essa razão, podemos afirmar que, dentro de um espaço, um gás nunca está confinado em um único local.

Representação da ocorrência de uma difusão
Além disso, podemos definir a difusão ainda como sendo a capacidade que um gás possui de se misturar com outro, quando colocados em um mesmo recipiente, formando uma mistura homogênea gasosa.
Um exemplo é quando os gases saem pelo escapamento dos veículos. Por mais que sejam tóxicos, não causam danos a curto prazo ao ser humano, pois se espalham por todo o ar atmosférico, reduzindo, consequentemente, sua concentração.
Efusão
Efusão é um fenômeno físico que consiste na travessia de um gás por orifícios existentes nas paredes de um determinado recipiente, ou seja, consiste na saída de um gás de um ambiente para outro.

Representação da ocorrência de uma efusão
Um exemplo é quando os balões são cheios para uma festa e, no dia seguinte, estão todos murchos, tudo por causa da saída do ar pelos orifícios contidos nos balões.
Cálculos relacionados com a difusão e efusão
Podemos calcular, de acordo com equações propostas por Graham, a velocidade em que um gás realiza a difusão ou a efusão. De acordo com Graham, as velocidades de difusão e efusão de dois gases misturados em um recipiente são sempre inversamente proporcionais ao quadrado das suas densidades relativas ou das suas massas molares.
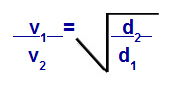
Lei de Graham com relação à densidade
-
v1 = velocidade (efusão ou difusão) do gás 1 da mistura;
Não pare agora... Tem mais depois da publicidade ;) -
v2 = velocidade (efusão ou difusão) do gás 2 da mistura;
-
d1 = densidade do gás 1 da mistura;
-
d2 = densidade do gás 2 da mistura;
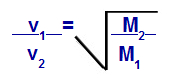
Lei de Graham com relação à massa molar
-
v1 = velocidade (efusão ou difusão) do gás 1 da mistura;
-
v2 = velocidade (efusão ou difusão) do gás 2 da mistura;
Não pare agora... Tem mais depois da publicidade ;) -
M1 = massa molar do gás 1 da mistura;
-
M2 = massa molar do gás 2 da mistura.
Por Me. Diogo Lopes Dias