O sabão em pó é um produto de limpeza que faz parte do dia a dia de uma grande parcela da população, já que é utilizado para facilitar a lavagem das roupas das pessoas. Trata-se de um produto que veio substituir o sabão em barra, já que, no processo de lavagem em geral, as pessoas tinham o hábito de esfregá-lo nas roupas.

Sabão em barra ainda é muito utilizado em lavagens de vasilhas, por exemplo
O sabão em pó foi fabricado pela primeira vez no ano de 1946, após algumas tentativas de tornar o uso do sabão em barra mais fácil. Uma das tentativas era fabricar o sabão em flocos ou grânulos. Todavia, essas tentativas não foram bem-sucedidas porque o sabão interage com íons presentes na água dura, principalmente, prejudicando a ação de limpeza.
-
Por que não podemos chamar o sabão em pó dessa forma?
Quimicamente falando, não podemos chamar o sabão em pó dessa forma. Se observarmos as embalagens desses produtos, veremos que está escrito lava-roupas, e não sabão em pó. O correto é chamá-lo de detergente em pó, pois sua composição química é diferente da composição de um sabão.
A química do sabão em pó, ou melhor, do detergente em pó, está pautada na diferença básica entre um sabão e um detergente. Veja a definição e as características químicas desses materiais:
a) Detergentes:
São substâncias químicas que apresentam cadeias muito longas (quantidade grande de carbonos) constituídas apenas por átomos de carbono e hidrogênio, configurando aquilo que chamamos de regiões apolares. Além disso, na extremidade dessa cadeia longa, há um grupo polar.
A parte polar do detergente deve-se à presença de um grupo sulfonato, isto é, um átomo de enxofre interagindo com três átomos de oxigênio, ou de um grupo fosfato, que apresenta um átomo de fósforo interagindo com três átomos de oxigênio. Veja a representação da estrutura de um detergente:
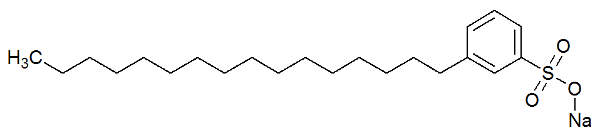
Fórmula estrutural de um detergente
A parte polar (formada pelo sulfonato de sódio) do detergente é capaz de interagir com as moléculas de água. Já a parte apolar (formada apenas por carbonos e hidrogênios) interage com as moléculas de gordura. Assim, o detergente faz a gordura interagir com a água e formar uma emulsão.
b) Sabões
São sais de ácidos carboxílicos originados a partir da reação química entre gorduras e bases fortes, como o NaOH. Veja a representação da estrutura química do sabão:
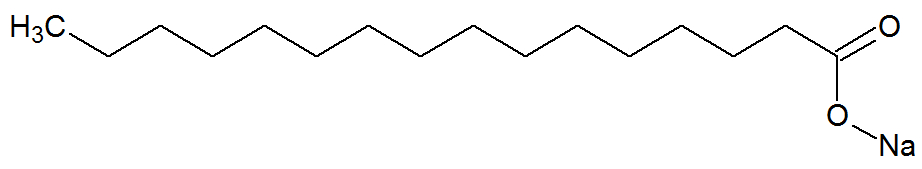
Fórmula estrutural de um sabão
Eles também apresentam cadeias carbônicas longas com uma parte apolar e polar. Dessa forma, a parte apolar (formada apenas por carbonos e hidrogênios) do sabão consegue interagir com gorduras, e sua parte polar (formada pelo grupo COONa), com a água, forma emulsões, como os detergentes.
Como o foco deste texto é a química do “sabão” em pó, ou melhor, a composição química do detergente em pó, apresentamos todas as substâncias químicas que fazem parte da sua composição, bem como a importância de cada uma delas:
Composição Química do Detergente em Pó
-
Tensoativo aniônico (como alquil benzeno sulfonato de sódio e alquil éter sulfonato de sódio). Eles se unem à molécula de gordura e também à da água, retirando, assim, a gordura do tecido;
-
Enzimas: Lipases e proteases são utilizadas com o objetivo de auxiliar na remoção de manchas. Isso acontece porque, quimicamente, as enzimas são catalizadores bioquímicos que promovem a transformação de moléculas complexas em moléculas mais simples. Assim, moléculas menores podem ser removidas de forma mais fácil das roupas;
-
Alvejante (Perborato de Sódio): Ele age por oxidação, redução ou ação enzimática. Em água, produz o peróxido de hidrogênio, que é um poderoso agente oxidante. Eles reagem quimicamente com o pigmento da roupa, modificando a estrutura e resultando em uma mudança de coloração;
-
Bloqueadores ópticos: são substâncias que absorvem a radiação ultravioleta ou luz ultravioleta e, logo em seguida, emitem uma luz azul fluorescente, mascarando, por exemplo, a coloração amarelada da roupa;
-
Fragrâncias: São essências utilizadas para deixar um odor agradável nas roupas após o processo de lavagem. Vale ressaltar que as fragrâncias são essências (pertencem à função éster);
-
Corantes: Substâncias utilizadas para dar cor ao produto;
-
Agentes sequestrantes e quelantes: O EDTA (ácido etilenodiamino tetra-acético) é um exemplo de sequestrante. Eles interagem com os íons cálcio, magnésio e ferro presentes principalmente na água dura, não permitindo a interação de nenhum componente de ação de limpeza, como o tensoativo.
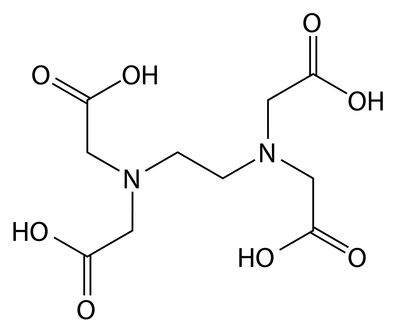
Fórmula estrutural do sequestrante EDTA
Por Me. Diogo Lopes Dias
