Para entendermos o porquê de ao queimarmos a madeira, ela não derreter, vamos relembrar primeiro o que é uma substância derretida, isto é, que está no estado líquido.
A diferença entre os estados sólido, líquido e gasoso está somente no estado de agregação das partículas. Nos três estados, a substância é composta das mesmas partículas, porém existe um maior ou menor espaço entre elas.
No estado sólido, as partículas se encontram mais unidas, sem muita liberdade de movimento. Já no estado líquido, as partículas possuem mais liberdade e podem se movimentar.
Acontece que grande parte da madeira (50%) é feita de celulose, que é na verdade um polímero. Um polímero é formado pela união de várias moléculas, chamadas monômeros. No caso da celulose, ela é formada pela união de centenas de moléculas de β-glicose, como mostrado abaixo. A celulose possui então a fórmula (C6H10O5)n e atinge massas moleculares de ordem de 400.000 u.
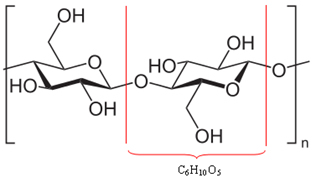
Visto que são moléculas enormes, esses polímeros que constituem a madeira não podem se mover com facilidade. Além disso, veja que as moléculas de β-glicose que compõem a celulose possuem grupos hidroxila (─ OH). Esses grupos realizam ligações de hidrogênio entre si, que é o tipo de força intermolecular mais intensa, mantendo o polímero bastante unido.
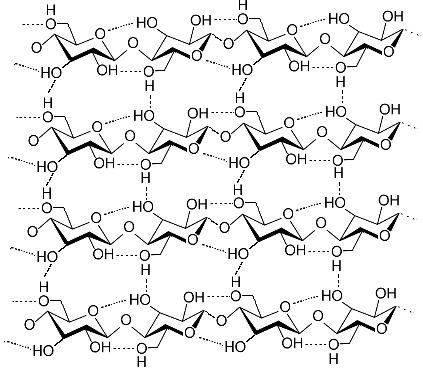
Ligações de hidrogênio entre moléculas que compõem o polímero da celulose*
Desse modo, para romper essas ligações, teríamos de inserir uma energia muito grande no sistema, ao ponto de a madeira se decompor antes mesmo de derreter e, então, não ser mais madeira.
Assim, quando queimada, a madeira passa por uma reação química, que é mais do que uma simples mudança de estado físico. Suas moléculas acabam se quebrando e recombinando com o oxigênio presente no ar, formando então novas substâncias, como o gás carbono e a água.

* Fonte e autor da imagem: Laghi.l.
Por Jennifer Fogaça
Graduada em Química
