Hibridização do tipo sp2
A hibridização do tipo sp2 ocorre com átomos de carbono que estabelecem uma ligação dupla.
A hibridização do carbono do tipo sp2 ocorre quando ele apresenta uma ligação dupla e duas ligações simples ou uma ligação pi (π) e três ligações sigma (σ). Na realidade, a hibridização sp2 é ocasionada entre os átomos que estabelecem a ligação dupla.
Um exemplo de molécula assim é a do formol (CH2O). Observe sua estrutura abaixo:
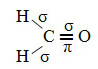
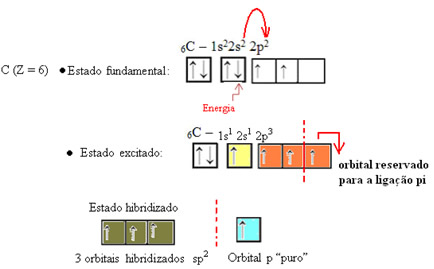
Conforme visto no texto “Hibridização do tipo sp3”, a hibridização do carbono ocorre quando um elétron do subnível 2s recebe energia e é “transportado” para o subnível 2p e, desse modo, originam-se 4 orbitais hibridizados a partir da “mistura” de orbitais atômicos puros.
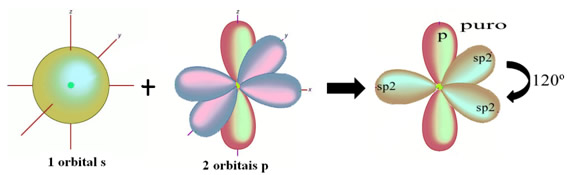
No caso do formol, sabemos que haverá uma ligação pi, portanto, um desses orbitais hibridizados é reservado para essa ligação, enquanto que os outros três realizam as ligações sigma:
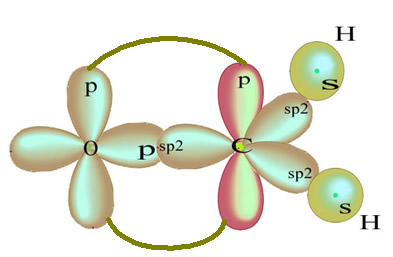
Os átomos de hidrogênio que realizam a ligação simples com o carbono, realizam-na com o seu orbital s:
O orbital p “puro” que restou realiza a ligação dupla com o átomo de oxigênio e a molécula de formol fica com a seguinte estrutura:
Quanto ao tipo de ligações existentes nessa estrutura do formol, temos:
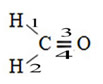
Ligações: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Por Jennifer Fogaça
Graduada em Química
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm