Conforme mostrado nos textos “Espectro eletromagnético dos Elementos Químicos” e “Espectros de Emissão e de Absorção e Leis de Kirchhoff”, os espectros descontínuos de emissão de cada elemento químico são diferentes.

Assim, abaixo temos os espectros distintos de alguns desses elementos:

Desse modo, o físico dinamarquês Niels Böhr (1885-1962) percebeu que isso poderia estar relacionado à estrutura do átomo de cada um desses elementos. Por isso, ele propôs um modelo atômico que complementava o modelo de Rutherford, mas que se concentrava no comportamento dos elétrons ao redor no núcleo do átomo.
Algum tempo antes, Max Planck (1858-1947) havia proposto uma teoria que afirma que os elétrons são quantizados, no sentido de que eles emitem e absorvem quantidades específicas de energia, como se fossem pequenos pacotes de energia, os quais ele chamou de quanta (quantum, no singular).
Assim, Böhr propôs o seguinte: visto que cada elemento tem um espectro diferente, cada elemento possui em seu átomo elétrons de energias constantes e diferentes de elemento para elemento.
Cada elétron só pode ficar em determinada órbita específica, pois em cada uma dessas órbitas o elétron apresenta energia constante, bem definida e característica. O elétron só pode ocupar os níveis energéticos dos quais ele possua a energia respectiva.
Os espectros são descontínuos porque os elétrons são quantizados.
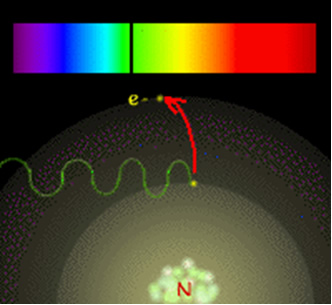
Um elétron só poderá mudar de nível se ele absorver energia. Por exemplo, quando se queima um sal do sódio no bico de Bunsen, estamos fornecendo energia para os elétrons. Ao absorver um quantum de energia, o elétron salta para o outro nível mais energético, ficando no estado excitado. Porém, o estado fundamental é mais estável, por isso esse elétron emite a energia absorvida e volta para a sua órbita original. Ele emite essa energia na forma de ondas eletromagnéticas que podem ser visualizadas na forma de luz. No caso do sódio, essa luz é na cor amarela intensa. Assim, quando essas ondas passam por um prisma, obtém-se o espectro descontínuo do sódio.
Assim, para Böhr, cada linha luminosa que aparecia no espectro descontínuo dos elementos indicava a energia liberada quando o elétron voltava de um nível mais externo para o outro mais próximo do núcleo.
A figura abaixo ajuda a entender melhor essa questão:
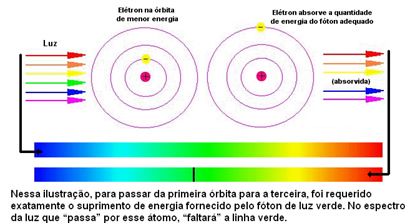
Como para os átomos de cada elemento só são permitidos determinados valores de energia que correspondem às camadas energéticas, para cada elemento se tem, então, um espectro diferente.
Por Jennifer Fogaça
Graduada em Química