Quando submetemos elementos diferentes à ação de uma chama, notamos que cada um emite uma coloração diferente. Por exemplo, se queimarmos um sal de estrôncio, um de sódio e um de cobre, veremos, respectivamente, as cores vermelho, amarelo intenso e verde, conforme a figura a seguir:

Se a luz dessas chamas incidir sobre um prisma, será obtido um espectro descontínuo, ou seja, serão observadas apenas algumas linhas luminosas coloridas intercaladas por regiões sem luz. Para cada elemento, teremos um espectro diferente.
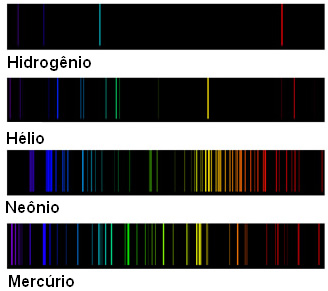
Esses tipos de espectros são chamados de espectro de emissão, pois foram emitidos por determinado elemento e servem para identificá-lo.
É possível conseguir espectros assim por meio de um feixe de luz produzido em um tubo de descarga elétrica a elevadas temperaturas e baixas pressões, que contenha gases de determinados elementos como o hidrogênio, ou como os gases nobres abaixo:

Ao passar essa radiação eletromagnética (luz) produzida, por um prisma, obtêm-se os espectros de emissão de cada um desses elementos.
Antigamente, achava-se que o espectro solar conseguido era totalmente contínuo, porém o cientista inglês William Hyde Wollaston descobriu que ao trabalhar com um feixe de luz muito estreito, com uma fenda de cerca de 0,01 mm, podia-se observar que o espectro solar continha sete linhas negras sobre ele. Mais tarde, o jovem Joseph Fraunhofer (1787-1826), usando prismas e grades de difração, constatou que o espectro solar na realidade contém milhares de linhas negras sobrepostas.
Algum tempo depois o físico Gustav Robert Kirchhoff percebeu que as manchas amarelas, conseguidas pelo espectro do sódio, ficavam exatamente no mesmo lugar que duas linhas negras do espectro do Sol. Ele e o químico Robert Wilhelm Bunsen realizaram vários experimentos e notaram que se passassem uma luz branca do bico de Bunsen, como a luz solar, pela luz amarela emitida pelo sódio e o prisma fosse atravessado para gerar o espectro; o resultado seria o espectro solar contínuo, com as cores do arco-íris, porém, com as linhas negras (chamadas de linhas D por Fraunhofer) na mesma posição das linhas amarelas do espectro do sódio.
.jpg)
O Sol emite luzes de todas as cores, do vermelho ao violeta, porém, ao passar pela atmosfera terrestre, os gases presentes absorvem a luz do Sol exatamente nas cores que emitem.
Esses tipos de espectros são denominados espectros de absorção.
Baseado nessas observações, Kirchhoff criou três Leis para a Espectroscopia, que são:
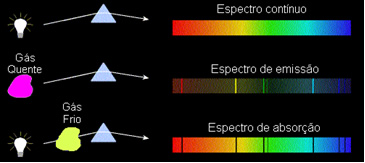
1) Um corpo opaco quente, em qualquer dos três estados físicos, emite um espectro contínuo.
2) Um gás transparente – como os dos gases nobres que vimos acima – produz um espectro de emissão, com o aparecimento de linhas brilhantes. O número e a posição dessas linhas serão determinados pelos elementos químicos presentes no gás.
3) Se um espectro contínuo passar por um gás à temperatura mais baixa, o gás frio causa a presença de linhas escuras, ou seja, será formado um espectro de absorção. É o que ocorreu com o espectro da luz do Sol ao passar pelo gás do sódio. Nesse caso, o número e a posição das linhas no espectro de absorção também dependem dos elementos químicos presentes no gás.
Por Jennifer Fogaça
Graduada em Química

