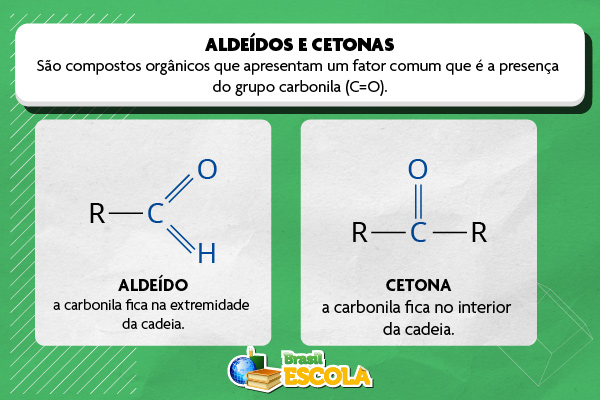
Aldeídos e cetonas são classes de compostos orgânicos de ocorrência natural, mas que também podem ser sintetizados em laboratório. Embora sejam diferentes, eles apresentam um fator comum que é a presença do grupo carbonila (C=O), por isso são também conhecidos como substâncias carboniladas.
Ambos estão envolvidos em vários processos bioquímicos e industriais de relevância, a exemplo do acetaldeído, formado na metabolização do etanol pelo fígado e cuja acumulação pode causar efeitos tóxicos. Já as cetonas, ácido acetoacético e acetona, fazem parte do metabolismo dos lipídios, sendo produzidas em estados de jejum prolongado ou diabetes descontrolado, resultando na chamada cetose.
No meio ambiente, aldeídos podem ser liberados por processos naturais, como a decomposição de matéria orgânica, e por fontes antropogênicas, como a queima de combustíveis fósseis. O formaldeído, por exemplo, é um poluente atmosférico com impacto na qualidade do ar e na saúde humana, sendo encontrado em emissões veiculares e em materiais de construção. Cetonas, por outro lado, são menos reativas no meio ambiente e frequentemente utilizadas como solventes em processos industriais, contribuindo para a formulação de produtos de limpeza, tintas e adesivos.
Leia também: Como são classificadas as cadeias carbônicas?
Tópicos deste artigo
- 1 - Resumo sobre aldeídos e cetonas
- 2 - O que são aldeídos e cetonas?
- 3 - Quais as diferenças entre aldeído e cetona?
- 4 - Nomenclatura de aldeídos e cetonas
- 5 - Principais reações de aldeídos e cetonas
- 6 - Exercícios resolvidos sobre aldeídos e cetonas
Resumo sobre aldeídos e cetonas
- Aldeídos e cetonas são compostos orgânicos conhecidos como substâncias carboniladas, ou seja, que têm a carbonila.
- Nos aldeídos, a carbonila está na extremidade da cadeia, enquanto nas cetonas está no interior.
- Aldeídos são mais reativos devido ao hidrogênio ligado à carbonila, o que os torna mais suscetíveis à oxidação, enquanto as cetonas são mais estáveis.
- Aldeídos oxidam-se facilmente, tornando-se ácidos carboxílicos sob condições brandas, enquanto cetonas necessitam agentes oxidantes mais fortes.
- Na nomenclatura, os aldeídos terminam em “-al” e as cetonas em “-ona”.
- Teste de Tollens: Aldeídos reagem formando um espelho de prata; cetonas não reagem.
- Teste de Fehling: Aldeídos produzem um precipitado avermelhado de Cu2O; cetonas não apresentam reação.
- Ambos podem ser reduzidos a álcoois; contudo, com aldeídos formando álcoois primários e cetonas, álcoois secundários.
O que são aldeídos e cetonas?
Aldeídos e cetonas são classes de compostos orgânicos caracterizados pela presença do grupo carbonila (C=O), porém diferem na posição desse grupo funcional na cadeia carbônica, isto é, enquanto nos aldeídos a carbonila aparece sempre na extremidade da molécula, ligada a um átomo de hidrogênio e a um grupo alquila ou arila, nas cetonas, esse grupo encontra-se entre dois átomos de carbono, ou seja, no interior da cadeia. Nesse sentido, cada função química é representada da seguinte forma:

Com base nisso, vejamos, a seguir, exemplos de alguns compostos das duas classes.
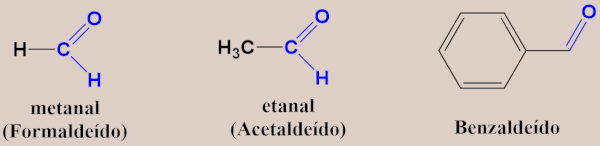
- Exemplos de aldeídos:
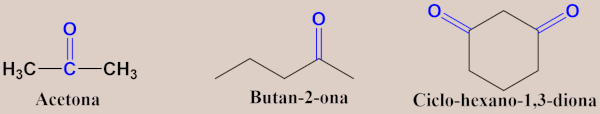
- Exemplos de cetonas:
Quais as diferenças entre aldeído e cetona?
Vimos que a principal diferença entre um aldeído e uma cetona está na posição da carbonila na cadeia carbônica. Nos aldeídos, a carbonila está na extremidade da cadeia, enquanto nas cetonas está no interior. Existem ainda outras diferenças entre eles, como a reatividade química e a resistência à oxidação.
Aldeídos, por exemplo, tendem a ser mais reativos devido à presença do hidrogênio diretamente ligado à carbonila, oxidam-se com mais facilidade, transformando-se em ácidos carboxílicos sob condições brandas. Por outro lado, as cetonas são mais resistentes a esse processo e só sofrem oxidação em condições extremas devido à maior estabilidade proporcionada pelos grupos alquila ligados à carbonila.
Veja também: Amida — grupo funcional que apresenta a carbonila ligada a um nitrogênio
Nomenclatura de aldeídos e cetonas
A nomenclatura de aldeídos e cetonas segue as regras da Iupac (União Internacional de Química Pura e Aplicada), de modo que, para os aldeídos, devemos proceder da seguinte forma:
- Identificar a cadeia principal, a qual deve ser a mais longa que contém o grupo -CHO.
- Enumerar a cadeia principal a partir do carbono do grupo -CHO, pois é prioritário.
- Usar prefixos para indicar a quantidade de carbonos que há na cadeia principal, quais sejam:
|
Prefixo |
Nº de carbonos |
Prefixo |
Nº de carbonos |
|
Met- |
1 |
Hex- |
6 |
|
Et- |
2 |
Hept- |
7 |
|
Prop- |
3 |
Oct- |
8 |
|
But- |
4 |
Non- |
9 |
|
Pent- |
5 |
Dec- |
10 |
4. Usar infixos para indicar os tipos de ligações entre carbonos.
|
simples |
dupla |
|
-an- |
-en- |
|
− |
= |
5. O nome do aldeído termina com o sufixo “-al”.
6. Quanto aos substituintes, se houver ramificações ou outros grupos funcionais, eles devem ser indicados com prefixos e numerados de acordo com sua posição na cadeia.
Obs.: Caso não haja insaturações ou substituintes, a enumeração da cadeia não é significativa para o nome do composto, já que o grupo funcional dos aldeídos fica sempre nas extremidades.
Vejamos alguns exemplos:
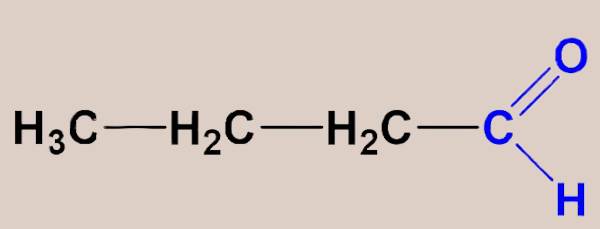
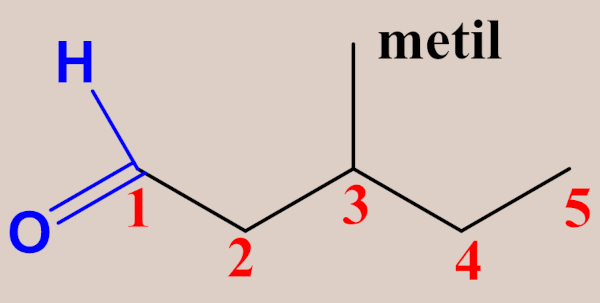
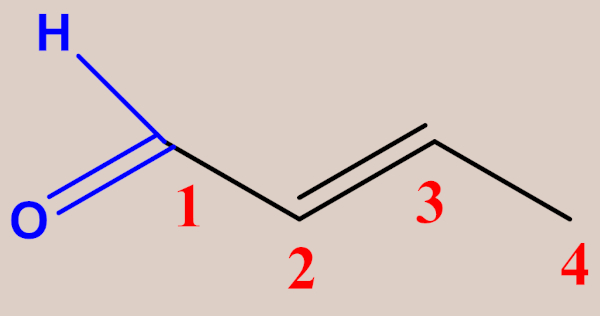
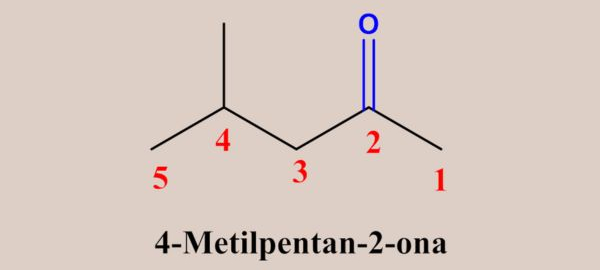
Já no caso das cetonas, as regras são praticamente as mesmas aplicadas aos aldeídos, exceto pela enumeração da cadeia, a qual deve começar pela extremidade mais próxima do grupo carbonila (já que, neste caso, a posição do grupo funcional pode variar), de modo que o carbono da carbonila deve receber o menor número possível. Veja alguns exemplos a seguir:
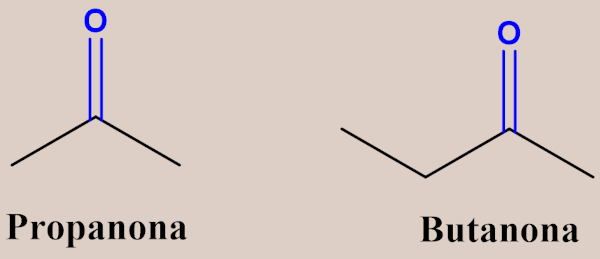
Obs.: Até quatro carbonos, a enumeração da cadeia é irrelevante para as cetonas, pois só há uma possibilidade para posição da carbonila.
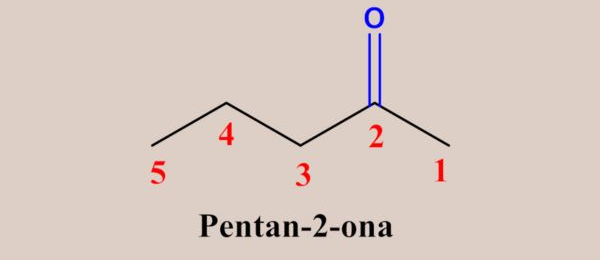

Principais reações de aldeídos e cetonas
As principais reações de aldeídos e cetonas incluem a oxidação, a redução e reações específicas, como a do teste de Tollens e a do teste de Fehling. Nesse sentido, falaremos um pouco sobre cada uma delas.
→ Oxidação
Diferencia aldeídos de cetonas, visto que aldeídos podem ser facilmente oxidados para ácidos carboxílicos na presença de agentes oxidantes, como permanganato de potássio (KMnO4) ou dicromato de potássio (K2Cr2O7), conforme é ilustrado a seguir.
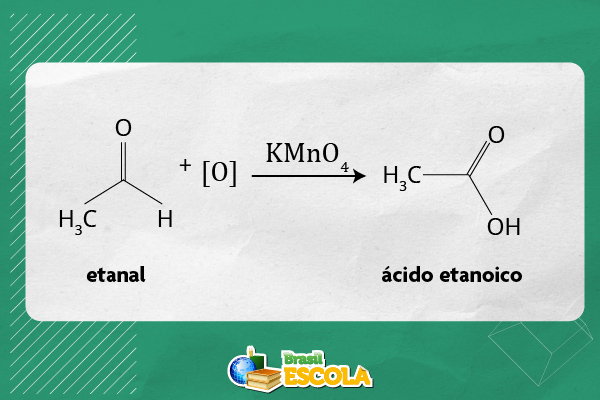
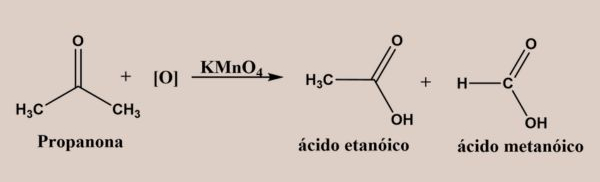
Já as cetonas, por não terem hidrogênio diretamente ligado à carbonila, são mais resistentes à oxidação, necessitando condições mais rigorosas para quebra da cadeia. Em vista disso, sob condições mais enérgicas, como oxidação com agentes fortes e aquecimento, a quebra da ligação C–C adjacente à carbonila pode ocorrer, resultando em ácidos carboxílicos de menor cadeia.
Um exemplo é a oxidação da propanona com permanganato de potássio em meio ácido:
→ Redução
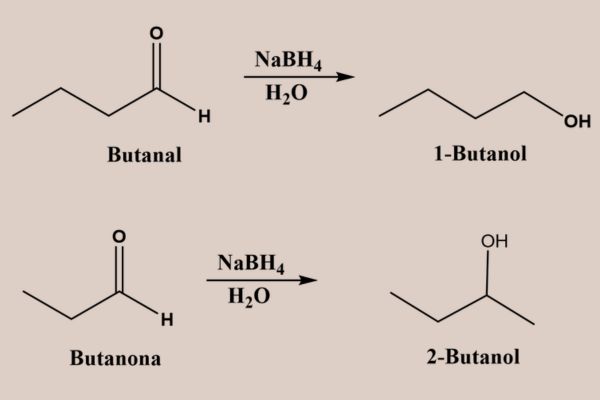
A redução transforma aldeídos e cetonas em álcoois. O uso de agentes redutores, como hidreto de lítio e alumínio (LiAlH4) ou boro-hidreto de sódio (NaBH4), leva à formação de álcoois primários nos aldeídos e álcoois secundários nas cetonas.
→ Testes de Tollens e Fehling
São métodos clássicos para diferenciar aldeídos de cetonas, ambos também envolvem reações de oxirredução, pois, nos dois casos, o aldeído é oxidado para ácido carboxílico; contudo, propiciam uma reação mais branda em relação a outros agentes redutores. Nesse caso, o primeiro utiliza uma solução amoniacal de nitrato de prata (AgNO3), que reage com aldeídos, formando um espelho de prata, mas não reage com cetonas. Por exemplo, a reação abaixo mostra reação do etanal (acetaldeído) com o regente de Tollens:
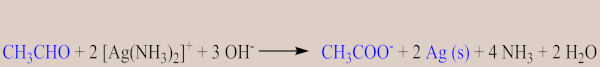
De modo geral, temos a seguinte reação:
Aldeído + Ag+ → Ácido carboxílico + Ag (s)
Observe na imagem abaixo o “espelho de prata” que é formado após a reação em um tubo de ensaio. Repare que a prata metálica adere às paredes do tubo.

Já o segundo, teste de Fehling, é baseado em uma solução alcalina de íons cúpricos (Cu2+), que detecta aldeídos pela formação de um precipitado avermelhado de óxido de cobre (Cu2O), enquanto cetonas não apresentam mudança significativa.
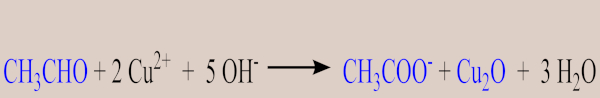
Nesse contexto, a equação simplificada fica assim:
Aldeído + Ag+ → Ácido carboxílico + Ag (s)
Na imagem abaixo, a solução azul contida nos tubos de ensaios no centro é o reagente de Fehling. Após reagir com aldeído, forma o precipitado Cu2O de tom avermelhado (tubos das extremidades):

Saiba mais: O que são hidrocarbonetos?
Exercícios resolvidos sobre aldeídos e cetonas
1) (IFN-MG) - Os aldeídos e cetonas são compostos que apresentam grupos funcionais parecidos. Esses compostos podem ser diferenciados por reações de oxidação, já que a reatividade deles é diferente mediante oxidantes fracos. Na FIGURA 01, são apresentados dois compostos (A e B) em que um deles corresponde a um aldeído e o outro, a uma cetona, não necessariamente nessa ordem.
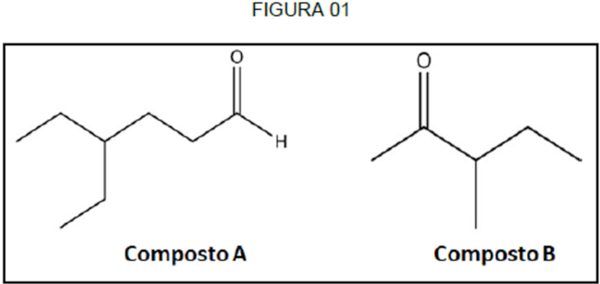
Um reagente que poderia ser utilizado para diferenciar esses compostos e suas identificações corretas estão presentes em:
a) reativo de Tollens/Composto A é o aldeído e Composto B é a cetona.
b) reativo de Baeyer/Composto A é a cetona e Composto B é o aldeído.
c) reativo de Benedict/Composto A é o aldeído e Composto B é a cetona.
d) reativo de Lucas/Composto A é a cetona e Composto B é o aldeído.
Gabarito: a
a) CORRETA - O reagente de Tollens é específico para aldeídos, que formam o “espelho de prata”. Cetonas não reagem para esse teste. Portanto, o composto A é o aldeído e composto B é a cetona.
b) ERRADA - O reagente de Baeyer não é adequado para diferenciar aldeídos de cetonas.
c) ERRADA - O reagente de Benedict é usado para açúcares redutores, não para diferenciar aldeídos de cetonas simples.
d) ERRADA - O reagente de Lucas é usado para álcoois, não para aldeídos ou cetonas.
2) Aldeídos e cetonas são compostos orgânicos que pertencem à função dos compostos carbonílicos, porém apresentam diferenças estruturais e reacionais importantes. Considerando essas diferenças, assinale a alternativa incorreta:
a) Aldeídos podem ser oxidados para ácidos carboxílicos sob condições brandas, enquanto cetonas requerem agentes oxidantes mais enérgicos.
b) O teste de Tollens diferencia aldeídos de cetonas, pois apenas os aldeídos reagem, formando um espelho de prata.
c) Tanto aldeídos quanto cetonas têm o grupo carbonila, mas nos aldeídos ele está ligado a, pelo menos, um hidrogênio, enquanto nas cetonas está ligado a dois grupos alquila.
d) Aldeídos e cetonas apresentam comportamento semelhante frente ao reagente de Fehling, pois ambos sofrem oxidação nas mesmas condições.
e) As cetonas, por não terem hidrogênio ligado a carbonila, são mais estáveis à oxidação, em comparação com os aldeídos.
Gabarito: d
Apenas aldeídos reagem com o reagente de Fehling, formando um precipitado vermelho de óxido de cobre (Cu2O). Já as cetonas não sofrem oxidação nas mesmas condições, pois não têm hidrogênio ligado ao carbono da carbonila.
Créditos das imagens
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. As técnicas de separação. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 801.
CONSTANTINO, M. G. Química Orgânica. In: Curso Básico Universitário: Química Orgânica. 1. ed. São Paulo: USP, 2005. v. 2p. 46–53.
SOLOMONS, T. G.; FRYHLE, G. B.; SNYDER, S. A. Aldeídos e Cetonas. In: Química Orgânica. 12. ed. Rio de Janeiro: GEN, 2018. p. 69–70.