A pressão de vapor é a pressão exercida por vapor com o seu líquido. Ela é uma importante propriedade no estudo do comportamento das substâncias em diferentes condições de temperatura e pressão. É de grande relevância em diversas áreas, como química, física e engenharia.
Leia também: Convecção — a transferência de calor que ocorre pela movimentação interna de fluidos
Tópicos deste artigo
- 1 - Resumo sobre pressão de vapor
- 2 - O que é pressão de vapor?
- 3 - Fórmula da pressão de vapor
- 4 - Como calcular a pressão de vapor?
- 5 - Tabela de pressão de vapor da água
- 6 - Pressão de vapor e ebulição
- 7 - Pressão de vapor e temperatura
- 8 - Pressão de vapor e volatilidade
- 9 - Pressão de vapor x pressão atmosférica
- 10 - Exercícios sobre pressão de vapor
Resumo sobre pressão de vapor
- A pressão de vapor é a pressão exercida pelo vapor de uma substância em equilíbrio com seu estado líquido ou sólido.
- A pressão de vapor aumenta com a temperatura, pois o aumento de energia facilita a evaporação.
- A ebulição ocorre quando a pressão de vapor de um líquido se iguala à pressão atmosférica.
- Substâncias com alta pressão de vapor são mais voláteis, como a acetona. Já líquidos com baixa volatilidade, como óleo, têm menor pressão de vapor e evaporam mais lentamente.
- A pressão de vapor da água aumenta exponencialmente com a temperatura.
O que é pressão de vapor?
A pressão de vapor é uma propriedade física de substâncias no estado líquido ou sólido que descreve a pressão exercida pelo vapor de uma substância quando está em equilíbrio dinâmico com seu estado condensado. Em outras palavras, é a pressão exercida pelas moléculas que se evaporaram de uma substância e estão na fase gasosa.
Fórmula da pressão de vapor
A fórmula que descreve a relação entre a pressão de vapor de uma substância e a temperatura é derivada da equação de Clausius-Clapeyron, uma expressão termodinâmica para processos de mudança de fase. A forma mais comum para calcular a pressão de vapor é:
\(\ln\left(\frac{P_2}{P_1}\right) = -\frac{\Delta H_{\text{vap}}}{R} \left(\frac{1}{T_2} - \frac{1}{T_1}\right)\)
- P1 e P2 : Pressões de vapor em duas temperaturas diferentes (T1 e T2).
- ΔHvap : Entalpia de vaporização (energia necessária para vaporizar uma unidade de substância, geralmente em J/mol).
- R: Constante universal dos gases, R = 8,314 J/mol ⋅ K.
- T1 e T2: Temperaturas absolutas correspondentes às pressões P1 e P2, em Kelvin (K).
Como calcular a pressão de vapor?
Para calcular essa pressão, você precisa de duas informações principais: a temperatura do sistema e a “facilidade” com que o líquido se transforma em vapor, que depende de uma propriedade chamada entalpia de vaporização. A pressão de vapor aumenta rapidamente com a temperatura porque o calor extra dá às moléculas mais energia para vencer as forças que as mantêm no líquido.
Exemplo: Sabendo que a entalpia de vaporização da água é de 40700 J/mol e que, na temperatura de 273,15 K, a pressão de vapor é de 613,283 Pa, encontre a pressão de vapor em temperatura de 278,15.
Resolução:
Para calcular a pressão de vapor, basta usar a equação de Clausius-Clapeyron:
\(\ln\left(\frac{P_2}{P_1}\right) = -\frac{\Delta H_{\text{vap}}}{R} \left(\frac{1}{T_2} - \frac{1}{T_1}\right) \)
\(\ln\left(\frac{P_2}{613,283}\right) = -\frac{40700}{8,314} \left(\frac{1}{278,15} - \frac{1}{273,15}\right) \)
\(\ln\left(\frac{P_2}{613,283}\right) = (-4895,357) \cdot (-0,00000658097) \)
\(\ln\left(\frac{P_2}{613,283}\right) = 0,322 \)
\(e^{0,322} = \frac{P_2}{613,283} \)
\(P_2=846,26 \ Pa\)
Tabela de pressão de vapor da água
Separamos abaixo uma tabela experimental que apresenta os dados da pressão de vapor da água em mmHg, em função da temperatura em °C:
|
Temperatura (°C) |
Pressão de vapor (mmHg) |
|
0 |
4,6 |
|
5 |
6,5 |
|
10 |
9,2 |
|
15 |
12,8 |
|
20 |
17,5 |
|
25 |
23,8 |
|
30 |
31,8 |
|
35 |
42,2 |
|
40 |
55,3 |
|
50 |
92,5 |
|
60 |
149,4 |
|
70 |
233,7 |
|
80 |
355,1 |
|
90 |
525,8 |
|
100 |
760 |
Note os seguintes detalhes:
- Em 100 °C, a pressão de vapor da água é igual à pressão atmosférica ao nível do mar (760 mmHg), o que corresponde ao ponto de ebulição da água.
- Os valores aumentam exponencialmente com a temperatura devido à maior energia térmica disponível para as moléculas escaparem do líquido.
Leia também: O que você precisa saber sobre as mudanças de estado físico da matéria
Pressão de vapor e ebulição
A ebulição ocorre quando a pressão de vapor do líquido se iguala à pressão externa, geralmente a pressão atmosférica. Nesse ponto, o líquido começa a formar bolhas de vapor dentro de seu volume, não apenas na superfície. Esse fenômeno só acontece quando as moléculas do líquido têm energia suficiente para superarem as forças que as mantêm no estado líquido e escaparem para a fase gasosa.
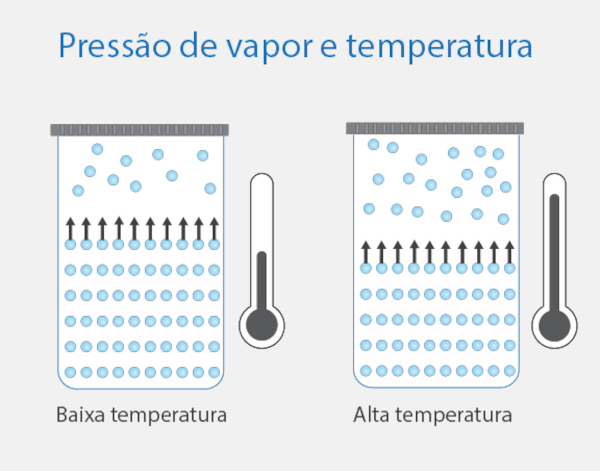
Pressão de vapor e temperatura
Como vimos na tabela anterior, conforme aumentamos a temperatura, a pressão de vapor também aumenta, porém de forma exponencial. Esse fenômeno ocorre, pois, em temperaturas mais altas, será maior o número de moléculas no estado físico gasoso, resultando em uma maior pressão de vapor.
Pressão de vapor e volatilidade
A volatilidade está associada à facilidade com que uma substância tem de passar do estado líquido para o gasoso, assim as substâncias que evaporam mais facilmente, como a acetona, são mais voláteis. Se uma substância tem uma pressão de vapor alta, significa que uma quantidade maior de moléculas do líquido está indo para o estado gasoso, então a substância se evapora com mais facilidade. Portanto, quanto maior a pressão de vapor de dada substância, maior será sua volatilidade.
Pressão de vapor x pressão atmosférica
Pressão de vapor e pressão atmosférica são dois conceitos físicos diferentes. Como vimos, enquanto a pressão de vapor é a pressão média exercida pelas moléculas de um vapor quando em equilíbrio com a fase líquida, a pressão atmosférica é a pressão exercida pelo ar contido na atmosfera sobre a superfície terrestre.
O valor da pressão atmosférica dependerá da altitude em que for medido. Em altitudes elevadas, como a do monte Everest, cujo pico está a 8848,86 metros acima do nível do mar, a pressão atmosférica será muito menor (240 mmHg) se comparada ao do nível do mar (760 mmGH). Isso acontece porque, conforme aumentamos a altitude, o número de moléculas de ar por unidade de volume vai diminuindo cada vez mais, até chegar ao valor zero, ao qual chamamos de vácuo.
Leia também: Como Torricelli mediu a pressão atmosférica?
Exercícios sobre pressão de vapor
Questão 1 (U.F. Viçosa-MG) Sabendo-se que as temperaturas de ebulição da água nas cidades A e B são, respectivamente, 95 °C e 100 °C, é correto afirmar que:
A) as duas cidades estão a uma mesma altitude.
B) a altitude de A é maior do que a de B.
C) a pressão atmosférica em A é maior do que em B.
D) a cidade A está situada ao nível do mar.
E) a pressão atmosférica é a mesma nas duas cidades.
Resolução:
Alternativa B
Como a temperatura de ebulição em A é menor, então a pressão atmosférica deve ser menor, portanto, A deve estar a uma altura maior do que a de B.
Questão 2 (UFRS) A água contida em uma bacia é colocada ao ar livre para evaporar. Qual das alternativas indica um processo que contribui para reduzir a quantidade de água evaporada por unidade de tempo?
A) Aumento da pressão atmosférica.
B) Redução da umidade relativa do ar.
C) Aumento da intensidade do vento.
D) Aumento da temperatura da água.
E) Mudança da água para uma bacia de diâmetro maior.
Resolução:
Alternativa A
O aumento da pressão atmosférica, sendo contrário à pressão de vapor, fará com que a água tenha mais dificuldade de evaporar.
Fontes
CARRON, Wilson; GUIMARÃES, Osvaldo. As faces da física (vol. único). 1. ed. Moderna, 1997.
HALLIDAY, David; RESNICK, Robert; WALKER, Jearl. Fundamentos da Física: Gravitação, ondas e termodinâmica (vol. 2). 9 ed. Rio de Janeiro, RJ: LTC, 2012.
NUSSENZVEIG, Herch Moysés. Curso de física básica: Fluidos, oscilações e ondas, calor (vol. 2). 4 ed. São Paulo: Editora Blucher, 2013.

