Nos estudos relacionados a mudanças de fase de substâncias, vemos que é possível provocar essa mudança mediante o fornecimento ou a retirada de energia térmica. Os exemplos mais simples dessa ocorrência são as mudanças de estado do sólido para líquido, do líquido para gasoso ou vice-versa. Por exemplo, se aquecermos um pedaço de gelo, ou seja, se fornecermos calor a ele, veremos que ele se funde (ou derrete).
Sendo assim, podemos dizer que mudança de estado é uma reorganização interna dos átomos (ou moléculas) de uma substância, causando modificações significativas em suas propriedades.
Curvas de aquecimento e de resfriamento: o que ocorre durante uma transição de fase.
Curvas de aquecimento ou de resfriamento mostram a variação da temperatura com o tempo à medida que o objeto vai perdendo ou ganhando energia.
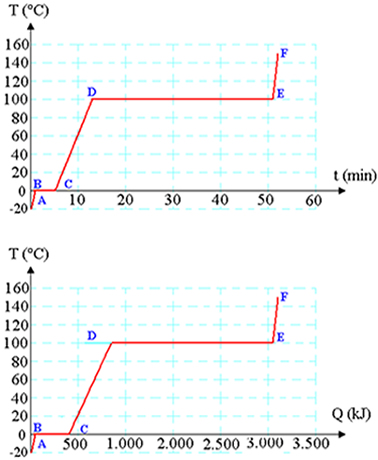
Vamos considerar uma quantidade de 1kg de gelo com uma temperatura inicial de -20°C (ponto A da figura acima) e que recebe uma taxa de calor constante de 1.000 watts, ou seja, 1.000 J/s.
Ao receber essa energia, as moléculas de água que estão organizadas como um sólido começam a oscilar cada vez mais rapidamente, causando um aumento linear na temperatura, que é determinado ela equação: Q = m.c.Δt.
Isto ocorre até o instante em que o gelo atinge a temperatura de 0°C, ponto B do gráfico, quando a oscilação das moléculas é tal que as ligações entre elas começam a se romper. Neste instante, o gelo começa a derreter e toda a energia fornecida passa a ser usada para romper as ligações que mantém a estrutura sólida.
Por este motivo, a temperatura fica constante até que todo o gelo esteja derretido, mesmo com a energia sendo continuamente fornecida. A energia fornecida durante a transição pode ser obtida da expressão Q = m.L.
A partir do instante em que o gelo está completamente derretido (ponto C), a temperatura da água aumenta constantemente. Suas moléculas vibram mais rapidamente até atingirem a temperatura de ebulição (ponto D).
O calor recebido a partir desse instante será usado para vaporizar a água, que permanece com temperatura constante até que o líquido tenha evaporado completamente (ponto E). Toda a energia recebida a partir desse ponto será usada para aquecer o vapor.
A construção de gráficos deste tipo, a partir de dados experimentais, permite determinar com exatidão as temperaturas de transição e os valores do calor específico e do calor latente.
Por Domiciano Marques
Graduado em Física