Quando uma substância é aquecida, ela recebe energia de forma que suas moléculas ficam agitadas, passando a ocupar um maior volume, ou seja, sofre dilatação. O oposto ocorre quando uma substância é resfriada, pois ela perde energia e suas moléculas tendem a ficar bem próximas umas das outras, causando uma contração no volume. Isso faz com que, normalmente, a matéria no estado sólido ocupe menos volume do que quando está no estado líquido.
Ao contrário do que acontece com a maioria das substâncias, a água possui um comportamento anômalo: quando é aquecida, entre os intervalos de 0 e 4º C, ela sofre contração e depois começa a dilatar-se, ou seja, quando a água está em seu estado sólido, ela tem volume maior do que no estado líquido nesse intervalo de temperatura. Esse comportamento irregular da água pode ser representado com o seguinte gráfico:
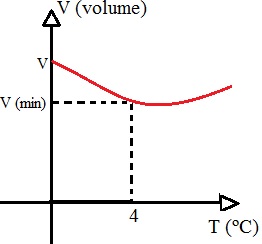
O volume da água diminui entre 0 e 4ºC e depois começa a aumentar
Se o volume da água diminui durante esse intervalo e sua massa é mantida constante, consequentemente a densidade da água, que é a razão entre a massa e o volume, será máxima quando a água estiver a 4ºC. Observe o gráfico:

Esse gráfico mostra que a densidade da água é máxima quando a temperatura é 4ºC
Mas qual é a razão para a dilatação anômala da água? Essa explicação é encontrada em sua constituição molecular. As moléculas da água são unidas por meio de ligações químicas denominadas Ligações de hidrogênio.
Quando a temperatura da água aumenta, acima de 0ºC, as ligações de hidrogênio começam a romper-se, ocorrendo uma aproximação entre as moléculas. Esse efeito supera a agitação térmica molecular, que causa o afastamento das moléculas e faz com que elas ocupem volume maior de tal forma que ocorre contração em seu volume.
Quando a temperatura supera os 4ºC, o número de ligações de hidrogênio já é bem reduzido. Dessa forma, começa a prevalecer o afastamento molecular, havendo, portanto, aumento em seu volume.
Esse comportamento irregular da água explica vários fenômenos naturais, entre eles o fato de o gelo flutuar na água, que é o que ocorre nas regiões muito frias, onde a superfície dos lagos fica congelada enquanto no fundo a água permanece líquida. Como a água tem densidade máxima a 4ºC, ela permanece no fundo, impossibilitando a convecção térmica, que é uma troca de calor em razão da diferença de densidade.
Por Mariane Mendes
Graduada em Física
