Conforme explicado no texto Reações de Adição, essas reações orgânicas ocorrem geralmente com compostos que possuem insaturação (ligações duplas ou triplas), em que a ligação pi é rompida, permitindo a entrada de átomos ou grupos de átomos na cadeia carbônica.
No entanto, esse tipo de reação também ocorre no caso de cicloalcanos (hidrocarbonetos de cadeia fechada com somente ligações saturadas (simples) entre os carbonos) que possuem três ou quatro átomos de carbono. Observe um exemplo a seguir, que é a bromação (reação de halogenação) do ciclopropano:
CH2
/ \ + Br2 → Br ─ CH2 ─ CH2 ─ CH2 ─ Br
H2C ─ CH2
Do mesmo modo, ocorre também a reação de adição chamada de hidro-halogenação ou de adição de halogenidretos, como a mostrada a seguir:
CH2
/ \ + HBr → H ─ CH2 ─ CH2 ─ CH2 ─ Br
H2C ─ CH2
Veja que, em ambos os casos, a molécula foi rompida e foram produzidos compostos de cadeia aberta.
Mas isso não ocorre com a mesma facilidade em cicloalcanos com cinco ou mais átomos de carbono. Por outro lado, esses compostos são mais propensos a realizar reações de substituição, em que a ligação não é rompida, mas sim um ou mais átomos de hidrogênio ligados ao carbono são substituídos por átomos de outros elementos.
O ciclopentano ainda consegue realizar reações de adição, mas somente com temperaturas mais elevadas (cerca de 300ºC). Já no caso do ciclo-hexano, isso é muito difícil. O que ele realiza mesmo são reações de substituição, como a cloração a seguir:
CH2 CH2
/ \ / \
H2C CH2 H2C CH ─ Cl
│ │ + Cl2 → │ │ + HCl
H2C CH2 H2C CH2
\ / \ /
CH2 CH2
Os anéis com cinco ou mais átomos de carbono não reagem com os ácidos halogenídricos, como o HBr, em reaões de adição.
Mas por que isso acontece? Por que os cicloalcanos de três ou quatro carbonos realizam reações de adição e os cicloalcanos com mais átomos de carbono têm a tendência de não realizar?
Bem, isso acontece porque o ciclopropano e o ciclobutano são mais instáveis, sendo, portanto, mais fácil romper as suas ligações.
Johann Friedrich Adolf von Bayer (1835-1917)
Para explicar isso, o químico alemão Johann Friedrich Adolf von Bayer (1835-1917) desenvolveu, em 1885, a chamada Teoria das tensões dos anéis, que mostrava que as quatro ligações realizadas pelos átomos de carbono seriam mais estáveis quando tivessem o ângulo igual a 109º 28', como é o caso do metano a seguir:
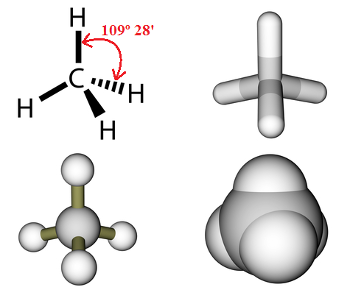
As quatro ligações simples do metano possuem o ângulo 109º 28'
Esse é o ângulo mais estável porque corresponde à maior distância possível entre os átomos, em uma geometria tetraédrica. Com isso, a repulsão eletrônica (repulsão entre os elétrons das camadas de valência dos átomos) fica menor.
Os cicloalcanos com três, quatro e cinco carbonos possuem os ângulos das ligações entre os carbonos menores que 109º 28' . Veja:
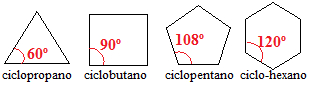
Ângulos de ligações de cicloalcanos
Com base nesses ângulos reais, que podemos chamar genericamente de α, pode-se realizar o cálculo da tensão da ligações, por meio da seguinte fórmula:
tensão = 109º 28' - α
2
Sabemos que o ciclopropano é o cicloalcano mais instável e também o mais reativo, e isso é confirmado pelo cálculo da tensão de seu anel em comparação com os demais:
tensão do ciclopropano = 109º 28' – 60º = 109º – 60º + 28' = 49º + 28' = 24,5º + 14
2 2 2
Como 0,5º = 30, então, temos:
tensão do ciclopropano = 24º + 30' + 14' = 24º 44'
tensão do ciclobutano = 109º 28' – 90º = 9º 44'
2
tensão do ciclopentano = 109º 28' – 108º = 0º 44'
2
Segundo a teoria das tensões de Bayer, quanto maior for essa tensão, mais instável será o ciclano, ou seja, quanto maior for a diferença entre o ângulo real (α) e o ângulo teórico (109º 28'), mais instável e, consequentemente, mais reativo será a substância.
É por isso que o ciclopropano é o menos estável dos cicloalcanos.
Entretanto, havia um erro na teoria de Bayer, pois, se continuarmos fazendo esse cálculo da tensão para o ciclo-hexano, em que o ângulo da ligação é de 120º, veremos que o valor será ainda menor que o do ciclopropano, dando igual a -5º 16'. Isso apontaria para o fato de que o ciclo-hexano deveria ser ainda mais instável e realizar reações de adição, o que não se verifica na prática.
A explicação para esse fato foi encontrada, em 1890, pelo químico alemão Hermann Sachse e comprovada, em 1918, pelo também químico alemão Ernst Mohr. Segundo esses cientistas, o erro na teoria das tensões de anéis de Bayer estaria no fato de que ele considerou que todos os cicloalcanos são coplanares, isto é, todos os seus átomos de carbono estão em um único plano, como os desenhos das estruturas deles mostrados acima.
Contudo, na realidade, os anéis dos cicloalcanos com mais de cinco átomos de carbono não são planos, mas seus átomos adquirem conformações espaciais que anulam as tensões entre as ligações, estabelecendo o ângulo de 109º 28' entre as ligações.
Por exemplo, veja o caso do ciclo-hexano. Ele não é, na realidade, plano com um ângulo de 120º entre suas ligações, mas, na verdade, seus átomos “contorcem-se”, formando duas possíveis conformações, a conformação “cadeira” e a “barco”:
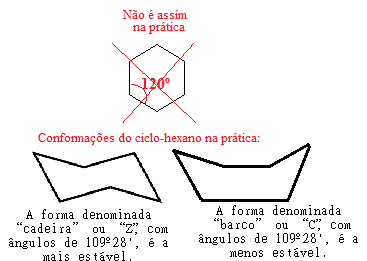
Possíveis conformações do ciclo-hexano na prática
Veja que, em razão do ângulo real do ciclo-hexano ser igual a 109º 28', ele é um composto bastante estável, por isso sua molécula não se rompe, não participando, assim, das reações de adição. Observe também que a forma “cadeira” é a mais estável, sendo a que sempre predomina em misturas, isso porque, nessa conformação, os átomos de hidrogênios ligados ao carbono ficam mais distantes uns dos outros.
Por Jennifer Fogaça
Graduada em Química