Quando vamos cozinhar algum alimento em nossas casas, utilizamos a combustão do gás de cozinha. Uma das coisas que podemos observar na chama resultante da combustão desse gás é que normalmente a cor dela é um azul bem claro. Porém, na maioria das reações de combustão, como, por exemplo, na queima de uma vela, a chama se apresenta na cor amarela.

Daí surge a pergunta:
“Se todo fogo é resultado de uma reação de combustão, por que algumas chamas possuem cores diferentes?”
Para entendermos como isso se dá, temos que entender o que é uma reação de combustão, e quais são as substâncias presentes em cada uma das reações citadas.
Uma reação de combustão ocorre quando um combustível (material oxidável) é consumido por um comburente (material gasoso contendo oxigênio) para gerar energia térmica (calor).
Outro ponto importante que precisamos saber sobre as reações de combustão é que elas podem se dar de forma completa ou incompleta. Se houver oxigênio suficiente para consumir o combustível, a reação será completa e produzirá gás carbônico (CO2) e água (H2O). Do contrário, a combustão será parcial, incompleta, gerando monóxido de carbono (CO) e água; ou carbono (C) e água.
Em ambos os casos que estamos analisando, o comburente é o oxigênio presente no ar. Entretanto, os combustíveis são diferentes. O gás de cozinha é na realidade o gás liquefeito de petróleo (GLP), que é uma mistura de hidrocarbonetos (alcanos), sendo que o principal combustível é o butano (C4H10). Assim, o gás de cozinha é constituído por moléculas de alcanos que possuem apenas três ou quatro átomos de carbono, por isso é necessário pouco oxigênio para que a sua combustão se dê de modo completo. Essa reação pode ser expressa da seguinte forma:
1 C4H10(g) + 13/2 O2(g) → 4 CO2(g) + 5 H2O(g), ∆H < 0
Já no caso da vela, a parafina é o combustível da reação, sendo que ela é constituída por uma mistura de alcanos com átomos de carbono que variam de 20 a 36. Com isso, precisa-se de muito mais oxigênio para que essa reação ocorra de modo completo. Veja um exemplo:
1 C24H50(s) + 70/2 O2(g) → 25 CO2(g) + 25 H2O(g), ∆H < 0
No ar não há oxigênio suficiente para realizar essa combustão completa, assim ela se dá de modo incompleto, como mostrado abaixo:
1 C24H50(s) + 49/2 O2(g) → 24 CO(g) + 25 H2O(g), ∆H < 0
1 C24H50(s) + 25/2 O2(g) → 24 C(s) + 25 H2O(g), ∆H < 0
As reações incompletas produzem menor energia que a combustão completa. Isso explica a diferença entre as cores das chamas, pois a chama amarela, característica da combustão incompleta, é de menor energia. Já a chama azul é característica de uma combustão completa, com maior energia.
Isso explica também a formação de fuligem pela chama da vela (foto abaixo), que é o carbono tido como produto da combustão incompleta.
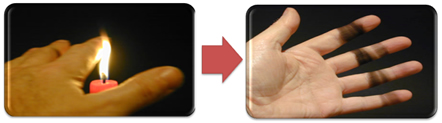
Mas por que, no bico de Bunsen, é possível conseguir chamas amarelas e azuis, sendo que o combustível não muda?
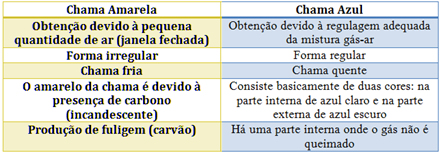
No caso do bico de Bunsen, isso é conseguido por meio da regulagem da entrada do gás e do ar. Se a janela ficar fechada, causando a entrada de uma pequena quantidade de ar, a chama obtida será a amarela, porque terá pouco oxigênio para realizar a combustão completa. Já se a regulagem da mistura gás-ar for adequada, obtemos uma chama azul.
Veja na tabela abaixo as características de cada uma:
Por Jennifer Fogaça
Graduada em Química
