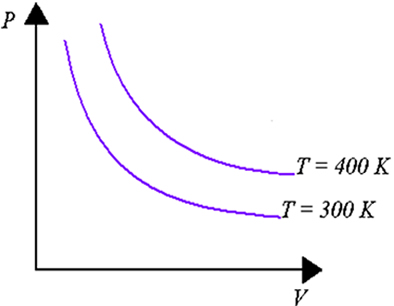
Primeira lei para processos isotérmicos
Nos processos isotérmicos, a temperatura do sistema se mantém constante durante todo o processo. Sendo assim, para gases ideais a energia interna também se mantém constante.

Videoaulas

Suponha que dois mols de um certo gás sofram uma transformação conforme mostra o gráfico abaixo da pressão vs. temperatura. Sendo a constante universal dos gases R = 8,31 J/mol.K, o calor molar a volume constante Cv = 4 cal/mol.K e o equivalente mecânico 1 cal = 4,18 J, determine a variação da energia interna e marque a alternativa correta.
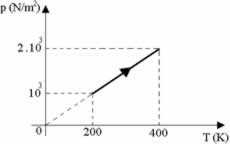
a) 8.866 J
b) 4.433 J
c) 6.975 J
d) 3.500 J
e) 6.688 J
Uma determinada massa gasosa sofre uma transformação isotérmica, conforme o diagrama, e recebe do meio externo, em forma de calor, 2000 J. Dada a constante universal dos gases R = 8,31 J/mol.K, determine respectivamente o volume final, a variação da energia interna e o trabalho realizado pelo gás e marque a alternativa correta.
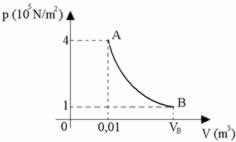
a) 0,04 m3, 200 J, 100 J
b) 0,04 m3, 10 J, 5 J
c) 0,04 m3, 0 J, 3200 J
d) 0,04 m3, 0 J, 2000 J
e) 0,04 m3, 200 J, 200 J
(UFRN) Um sistema termodinâmico realiza um trabalho de 40 kcal quando recebe 30 kcal de calor. Nesse processo, a variação de energia interna desse sistema é de:
a) – 10 kcal
b) zero
c) 10 kcal
d) 20 kcal
e) 35 kcal
(FMPA-MG) Sobre um gás confinado em condições ideais podemos afirmar corretamente que:
a) numa compressão isotérmica o gás cede calor para o ambiente.
b) aquecendo o gás a volume constante sua energia interna permanece constante.
c) numa expansão adiabática, a temperatura do gás aumenta.
d) numa expansão isobárica, a temperatura do gás diminui.
e) quando o gás sofre transformações num ciclo, o trabalho resultante que ele realiza é nulo.