Em 1913, Niels Bohr desenvolveu um modelo que apresentava concordância quantitativa precisa com alguns dos dados eletroscópios.
O modelo atômico de Bohr foi descrito através de quatro postulados, citados a seguir:
1- Um elétron em um átomo se move em órbita circular ao redor do núcleo sob a influência da atração coulombiana entre o elétron e o núcleo, obedecendo às leis da mecânica clássica.
2- Em vez de infinitas órbitas, possíveis na mecânica clássica, um elétron se move apenas em uma órbita na qual seu movimento angular é múltiplo inteiro de 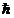 (constante de Planck h = 6,63x10-34 J.s, dividida por 2π).
(constante de Planck h = 6,63x10-34 J.s, dividida por 2π).
3- A energia total do elétron permanece constante. Isso ocorre porque o elétron que se move em uma órbita não emite radiação eletromagnética.
4- É emitida radiação eletromagnética se um elétron, que se move inicialmente sobre uma órbita de energia total Ei, muda seu movimento descontinuamente de forma a se mover em uma órbita de energia total Ef. A freqüência da radiação emitida é igual à quantidade (![]() ) dividida pela constante de Planck h, ou seja:
) dividida pela constante de Planck h, ou seja:
![]()
Este postulado mistura a física clássica com a física quântica. Um exemplo disso é que com relação ao movimento circular dos elétrons ao redor do núcleo, o primeiro postulado condiz com a mecânica clássica, e a idéia não clássica está na quantização do momento angular no segundo postulado.
A justificativa para os postulados de Bohr, ou para qualquer conjunto de postulados, só pode ser encontrada comparando-se as previsões que podem ser obtidas a partir dos postulados com os resultados experimentais
Esse postulado rendeu para Niels Bohr o prêmio Nobel de Física em 1922.
Por Kléber Cavalcante
Graduado em Física
Equipe Brasil Escola
Veja Mais!
O átomo de Bohr
.jpg)
