Antes de entendermos do que se trata o número quântico magnético e o número quântico spin, é necessário relembrar o que significa a palavra orbital.
Orbital é a região do espaço ao redor do núcleo onde é máxima a probabilidade de encontrar um determinado elétron.
Para entender melhor, pense em uma colmeia. Não é possível dizer com certeza a trajetória e a posição de cada abelha, no entanto, podemos indicar a região ao redor da colmeia onde é maior a probabilidade de se encontrar as abelhas. De maneira similar, o orbital indica a região ao redor do núcleo do átomo em que se determinará com maior probabilidade de acerto a posição dos elétrons.
Visto que o elétron tem característica dual, ou seja, se comporta como partícula e também como onda; os cientistas preferem identificá-lo de acordo com seu conteúdo de energia. Por meio de cálculos matemáticos, o cientista Erwin Schrödinger, em 1927, relacionou a natureza corpuscular, a energia, a carga e a massa do elétron. Assim, cada elétron passou a ser caracterizado por números quânticos.
Números quânticos são códigos matemáticos associados à energia do elétron.
Dois números quânticos mais conhecidos são o número quântico principal (n) e o secundário ou azimutal (l).O principal indica a camada ou nível de energia (K,L,M,N,O,P,Q) em que o elétron se encontra, indo, respectivamente, de 1 a 7. Já o azimutal representa os subníveis de energia (s,p,d,f), que são, respectivamente, 0,1,2,3. Ambos aparecem no diagrama energético a seguir, onde o número quântico principal representa as sete “escadas” e o número quântico secundário é representado pelos “degraus” das escadas.
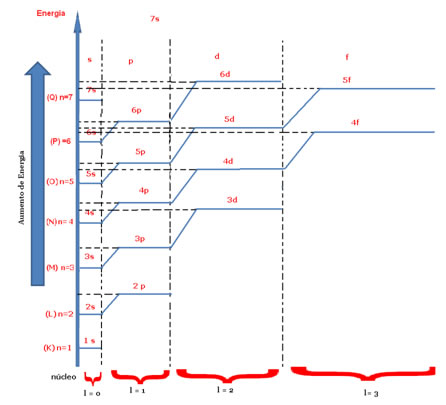
Agora consideremos o número quântico magnético e o do spin:
- Número Quântico Magnético (m ou ml) → indica a orientação dos orbitais no espaço.
Conforme o diagrama energético a seguir os valores de m são representados por quadradinhos (ou por bolinhas, dependendo do autor). Para cada orbital temos um valor para o número quântico magnético, que varia de –l a+l.
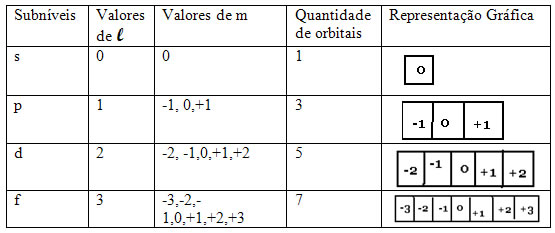
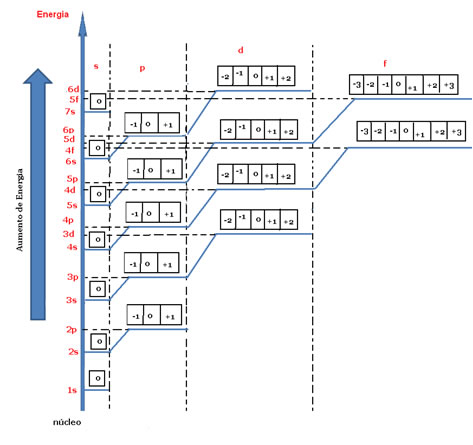
Diagrama energético indicando o número quântico magnético
- Número Quântico de spin (s ou ms)→Um orbital comporta no máximo dois elétrons. Eles não se repelem porque giram em sentidos opostos, criando campos magnéticos que se atraem. Assim, a força de atração, que é a magnética; e a de repulsão, que é a elétrica, ficam contrabalanceadas.

Spins opostos ou antiparalelos, elétrons girando em sentidos opostos.
Desse modo, representamos em cada quadradinho apenas dois elétrons no máximo, que são representados por setas e têm os valores de +1/2 e -1/2.
|
↑ |
Representa, por convenção, um elétron com spin negativo s = -1/2.
|
↓ |
Representa, por convenção, um elétron com spin positivo s = +1/2.
Para exemplificar, vamos ver o elemento hélio, que possui dois elétrons e só um nível de energia; seu símbolo é: 2He
|
↑↓ |
Sua representação simbólica é dada por:
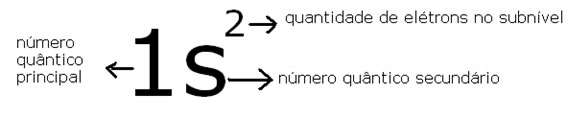
Representação da posição do elétron mais energético do Hélio
Assim, temos seus números quânticos do 1º e do 2º elétron:
1º elétron: 2º elétron:
n= 1 n= 1
l= 0 l=0
m= 0 m= 0
s= -1/2 s= +1/2
Por Jennifer Fogaça
Graduada em Química

.jpg)
