O pOH (potencial hidroxiliônico) é uma escala utilizada para expressar a concentração molar dos íons OH− presentes na solução. É uma escala complementar à escala pH e, por conta disso, seus valores possíveis variam de 0 a 14, quando a temperatura é de 25 °C. O pOH pode ser entendido como −log[OH−], que traz leituras mais simples dos níveis dos íons hidróxido na solução, uma consequência direta dos logaritmos. Além da fórmula, o pOH pode ser determinado indiretamente por meio dos valores de pH.
Leia também: Como se mede o pH de uma solução?
Tópicos deste artigo
- 1 - Resumo sobre pOH
- 2 - O que é pOH?
- 3 - Diferenças entre pH e pOH
- 4 - Fórmula do pOH
- 5 - Como calcular o pOH
- 6 - Para que serve o pOH?
- 7 - Exercícios resolvidos sobre pOH
Resumo sobre pOH
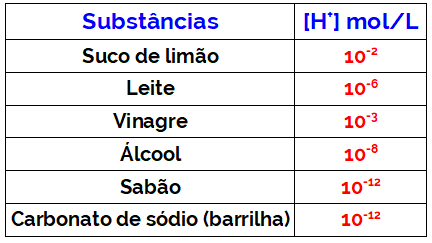
- O pOH é uma escala utilizada para expressar a concentração, em mol/L, dos íons hidróxidos presentes na solução.
- O pOH pode ser calculado por meio da fórmula −log [OH−].
- O pOH é complementar ao pH e, a 25 °C, a soma do pH com o pOH é igual a 14.
- A utilização do logaritmo torna os valores de pOH mais simples e de melhor interpretação.
- A escala pOH é importante na visualização dos níveis de alcalinidade do meio.
O que é pOH?
O pOH (potencial hidroxiliônico) é uma escala utilizada para expressar a concentração molar de íons OH− em solução. É complementar à escala pH e, por isso, também varia de 0 a 14 na temperatura de 25 °C.
Diferenças entre pH e pOH
As escalas pH e pOH são complementares, de modo que:
pH + pOH = pKw
E, portanto, a 25 °C:
pH + pOH = 14
Dessa forma, entende-se que, quanto maior o pH, menor o pOH. Sendo complementares, quando o pH é menor que 7 (faixa ácida), o pOH deve ser, portanto, maior que 7. Assim como quando o pH é maior que 7 (faixa básica), o pOH deve ser menor que 7.
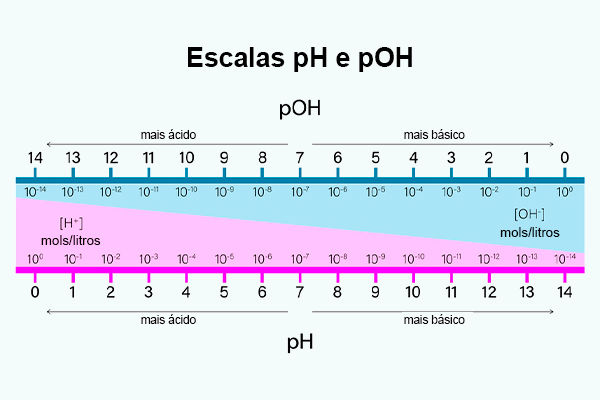
Outro ponto de diferença é que a escala pH serve para medir a concentração molar de íons H+ em solução, enquanto a escala pOH é utilizada para a medição da concentração molar de íons OH− em solução.
→ Videoaula sobre pH e pOH
Fórmula do pOH
Em Química, entende-se que “p” é um operador matemático que deve ser entendido como “−log”. Portanto, a quantidade pX pode ser entendida como:
pX = −log X
Dessa forma, tem-se que o pOH é:
pOH = −log [OH−]
A utilização do logaritmo simplifica a interpretação quantitativa de meios ácidos ou alcalinos e, por isso, é utilizada.
Veja também: Afinal, o que é o mol?
Como calcular o pOH
O pOH pode ser calculado por sua fórmula, ou seja, através de uma leitura direta da concentração de íons OH− no meio. Dessa forma, se a concentração de íons OH− no meio é de 1,0 x 10−4 mol/L, o pOH é dado por:
pOH = −log (1,0 x 10−4)
pOH = − (log 1 + log 10−4)
pOH = − (0 – 4 ∙ log 10)
pOH = − (−4 ∙ 1)
pOH = 4
Também pode ser determinado indiretamente, por meio da complementariedade com o pH. Suponhamos que, a 25 °C, o pH do fluido estomacal seja igual a 1,7. Dessa forma, o pOH será igual a:
pH + pOH = 14
1,7 + pOH = 14
pOH = 14 – 1,7
pOH = 12,3
Para que serve o pOH?

O pOH apresenta a concentração molar de íons OH− em solução. A sua vantagem é que, ao se utilizar de logaritmo, a interpretação se torna mais simples e direta, permitindo uma visualização melhor da acidez ou basicidade do meio. Por exemplo, se um meio reacional possui uma concentração de OH− igual a 10−5 mol/L, o pOH é igual a 5, um valor mais fácil de ser compreendido e interpretado.
Sendo complementar ao pH, o pOH também pode servir para mensurar a concentração molar de íons H+ de maneira indireta.
Saiba mais: Qual a diferença entre massa molar e número de mol?
Exercícios resolvidos sobre pOH
Questão 1. (UNEB 2º dia/2023) Cafeína, bebidas alcoólicas, cigarro e até o nervosismo também podem piorar problemas como gastrite e úlcera. Segundo pesquisas, o estresse é o fator que mais desencadeia crises estomacais. Isso ocorre porque, em situações de tensão, o sistema nervoso é acionado e estimula a produção de ácido clorídrico no estômago. Assim, o suco gástrico fica mais ácido e a agressão é maior.
Após análises numa amostra estomacal, o resultado do potencial hidrogeniônico encontrado foi de 3,1, portanto o potencial hidroxiliônico foi de
a) 1,2.
b) 6,1.
c) 7,9.
d) 9,5.
e) 10,9.
Resposta: Letra E.
Se o pH é igual a 3,1, então o pOH é calculado da seguinte forma:
pH + pOH = 14
3,1 + pOH = 14
pOH = 14 – 3,1
pOH = 10,9
Questão 2. (UEA Conhecimentos Gerais/2022) O controle de pH para a manutenção da qualidade da água de uma piscina é essencial, pois quando a água fica muito ácida ou muito básica pode ocorrer irritação dos olhos e das mucosas, além de ressecamento da pele e dos cabelos. Considere o produto iônico da água (Kw) a 25 ºC igual a 1 × 10−14 (mol/L)2.
A análise de uma amostra de água de uma piscina a 25 ºC encontrou uma concentração de íons OH− igual a 1 × 10−10,8 mol/L.
Nessas condições, a água dessa piscina está:
a) neutra e o pH = 7.
b) básica e o pOH = 10,8.
c) básica e o pH < 7.
d) ácida e o pH = 3,2.
e) ácida e o pOH = 3,2.
Resposta: Letra D.
Da expressão:
pOH = −log[OH−]
Podemos dizer que:
[OH−] = 10−pOH
Assim, o pOH é igual a 10,8 e, portanto, o pH é:
pH + pOH = 14
pH + 10,8 = 14
pH = 3,2
O que significa também que o meio é ácido.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.