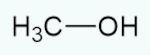Os álcoois são compostos orgânicos que possuem a presença de um ou mais radicais hidroxila (−OH) diretamente ligados a um carbono sp3 (que só faz ligações simples). Todos os álcoois, segundo a União Internacional de Química Pura e Aplicada (Iupac), devem possuir o sufixo “-OL” para serem devidamente identificados na nomenclatura oficial.
Os álcoois com até três carbonos são muito miscíveis em água e, pelo fato de o grupo hidroxila conseguir realizar ligações de hidrogênio, conseguem ter maior ponto de fusão e ebulição que hidrocarbonetos de tamanho semelhante. Entre os principais álcoois, figuram o metanol e o etanol.
Leia também: Cetonas — compostos que possuem uma carbonila ligada a dois átomos de carbono
Tópicos deste artigo
- 1 - Resumo sobre álcoois
- 2 - O que são álcoois?
- 3 - Nomenclatura de álcoois
- 4 - Classificação dos álcoois
- 5 - Fórmula dos álcoois
- 6 - Propriedades dos álcoois
- 7 - Exemplos de álcoois
- 8 - Exercícios resolvidos sobre álcoois
Resumo sobre álcoois
- Álcoois são compostos orgânicos que possuem o grupo −OH diretamente ligado a carbono sp3.
- Todo álcool, segundo a Iupac, deve apresentar sufixo “-OL” em sua nomenclatura.
- O grupamento hidroxila garante que álcoois com até três carbonos sejam totalmente solúveis em água.
- É também o grupo hidroxila que permite que álcoois realizem ligações de hidrogênio, aumentando suas temperaturas de fusão e ebulição.
- Entre os principais álcoois, figuram o metanol e o etanol.
O que são álcoois?

Os álcoois contemplam um grupo de compostos da Química Orgânica que são caracterizados pela presença de um ou mais radical hidroxila (−OH) diretamente ligado a um carbono tetraédrico (de hibridização sp3).
Nomenclatura de álcoois
Segundo a União Internacional de Química Pura e Aplicada, os compostos pertencentes à função álcool devem apresentar, em seu nome oficial, o sufixo “-OL”.
Quando se trata de um álcool com pelo menos três carbonos, ou que apresente mais de um radical hidroxila, a posição da hidroxila deve ser indicada no nome oficial, próximo ao sufixo.
|
Álcool |
Nome oficial |
|
|
Metanol |
|
|
Etanol |
|
|
Butan-2-ol |
|
|
Ciclopentanol |
|
|
Etano-1,2-diol |
Classificação dos álcoois
Os álcoois podem ser classificados de algumas formas, as quais vamos expor a seguir.
-
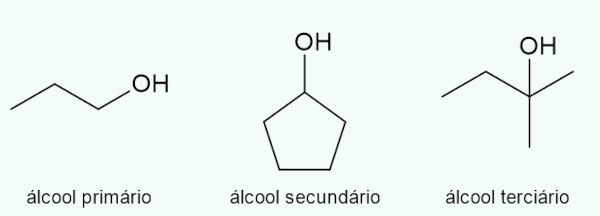
Quanto à natureza do carbono que a hidroxila se liga
Se a hidroxila se liga a um carbono primário, portanto o álcool será classificado como primário. Já se a hidroxila se liga a um carbono secundário, então o álcool será classificado como secundário. Por fim, caso a hidroxila esteja ligada a um carbono terciário, então o álcool será classificado como terciário.
-
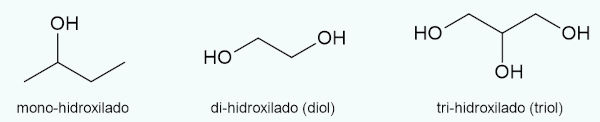
Quanto ao número de hidroxilas na cadeia
Os álcoois podem ser mono-hidroxilados, que são álcoois que possuem apenas uma única hidroxila ligada à cadeia. Já os álcoois poli-hidroxilados são aqueles que possuem, pelo menos, dois grupos hidroxila ligados à cadeia.
-
Quanto à natureza da cadeia carbônica
Os álcoois podem ser de cadeia aberta, quando a hidroxila se liga a uma cadeia aberta, ou de cadeia fechada, quando a hidroxila se liga a uma cadeia fechada.
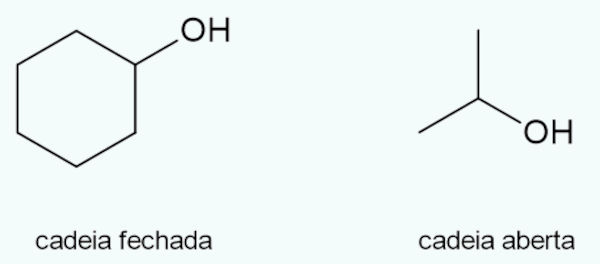
Fórmula dos álcoois
Todo álcool, sendo mono-hidroxilado, possui a fórmula geral R−OH, em que “R” significa uma cadeia carbônica qualquer. A única exigência é que o carbono ao qual a hidroxila se liga seja de hibridização sp³ (só realize ligações simples).
A fórmula molecular dos álcoois mono-hidroxilados de cadeia aberta segue a fórmula geral CnH2n+2O, que é a mesma dos éteres. Já os álcoois mono-hidroxilados de cadeia fechada seguem a fórmula molecular geral CnH2nO.
Leia também: Aminas — compostos orgânicos derivados da amônia
Propriedades dos álcoois
A hidroxila é um grupo que conta com o oxigênio, um átomo de elevada eletronegatividade. Por conta disso, podemos dizer que a hidroxila é um grupo polarizante e, assim sendo, permite que álcoois sejam solúveis em solventes polares, como é o caso da água. Especificamente sobre a água, o grupo hidroxila é capaz de realizar ligações de hidrogênio com ela, que se trata de uma interação muito forte em comparação às demais interações de caráter molecular, como dipolo-dipolo e as forças de dispersão de London.
Contudo, conforme a cadeia carbônica aumenta, o caráter apolar dela começa a se tornar mais significativo, diminuindo a solubilidade desses compostos em solventes polares, inclusive a água. Portanto, em termos de solubilidade, percebemos que os álcoois são mais solúveis em solventes polares quanto menor for a cadeia carbônica.
Outra forma de aumentar a solubilidade desses compostos em solventes polares é aumentando o número de radicais hidroxila. Entende-se que, de maneira geral, álcoois até três carbonos são totalmente solúveis em água. A seguir, os valores de solubilidade dos dez primeiros álcoois primários em água.
|
Álcool |
Solubilidade (g/kg de H2O) a 25 °C |
|
Metanol |
∞ |
|
Etanol |
|
|
Propan-1-ol |
|
|
Butan-1-ol |
79 |
|
Pentan-1-ol |
21,9 |
|
Hexan-1-ol |
5,9 |
|
Heptan-1-ol |
1,64 |
|
Octan-1-ol |
0,460 |
|
Nonan-1-ol |
0,129 |
|
Decan-1-ol |
0,037 |
Ainda dentro do campo da solubilidade, os álcoois, por conta da cadeia carbônica, também podem apresentar uma boa solubilidade em solventes apolares, como hidrocarbonetos e óleos. Essa solubilidade irá aumentar conforme o caráter apolar do álcool se torna mais significativo, ou seja, conforme a cadeia carbônica toma um volume maior. Por isso, é possível dizer que os álcoois podem ter caráter anfifílico: boa solubilidade em compostos polares e apolares simultaneamente.
Quando falamos em termos de mudanças de temperatura de fase, como ponto de fusão e ebulição, devemos atentar que os álcoois, entre si, conseguem realizar ligações de hidrogênio por meio do grupo hidroxila. Por conta disso, os álcoois possuem um ponto de ebulição muito maior em comparação aos hidrocarbonetos ou éteres (que são isômeros dos álcoois) de tamanho semelhante.
As temperaturas de mudança de fase também aumentam junto com o volume molecular, uma vez que a parte apolar (cadeia carbônica) realiza interações do tipo dipolo induzido-dipolo induzido, as quais são somativas, ou seja, quanto maior a cadeia, mais intensas são.
A tabela a seguir traz informações das temperaturas de mudança de fase dos dez primeiros álcoois primários, assim como suas densidades.
|
Álcool |
Ponto de fusão (°C) |
Ponto de ebulição (°C) |
Densidade (g/mL) |
|
Metanol |
-97,5 |
64,5 |
0,7914 |
|
Etanol |
-114,14 |
78,24 |
0,7893 |
|
Propan-1-ol |
-124,39 |
97,04 |
0,7997 |
|
Butan-1-ol |
-88,6 |
117,6 |
0,8095 |
|
Pentan-1-ol |
-77,58 |
137,6 |
0,8144 |
|
Hexan-1-ol |
-46,4 |
156,9 |
0,8136 |
|
Heptan-1-ol |
-33,2 |
178 |
0,8219 |
|
Octan-1-ol |
-14,7 |
194,7 |
0,8262 |
|
Nonan-1-ol |
-5 |
213,7 |
0,8280 |
|
Decan-1-ol |
7 |
229 |
0,8297 |
Um fato interessante é que a adição de um grupo hidroxila aumenta significativamente o ponto de fusão e ebulição do álcool. O etano-1,2-diol, por exemplo, possui um ponto de fusão de −13 °C e um ponto de ebulição de 197,5 °C, valores comparáveis ao octan-1-ol e muito acima do respectivo álcool mono-hidroxilado de dois carbonos, o etanol.
Quanto às densidades, percebe-se que os álcoois acabam sendo um pouco menos densos que a água, cuja densidade, durante sua faixa líquida, é aproximadamente igual a 1,0 g/mL.
Exemplos de álcoois
- Metanol (álcool metílico) – é o álcool mais simples, sendo utilizado como combustível. Ao ser ingerido, transforma-se em formaldeído, o que é bem tóxico para os seres vivos.
- Etanol (álcool etílico) – é muito aplicado para fins de energia, como combustível, assim como na fabricação de bebidas alcoólicas, solventes, além de produtos para uso doméstico, como sanitizantes, e cosméticos.
- Propan-2-ol (álcool isopropílico) – também muito usado como solvente, é amplamente empregado na limpeza de dispositivos eletrônicos e chips de computador.
- Propano-1,2,3-triol (Glicerol) – também conhecido como glicerina, é muito utilizado na indústria farmacêutica, de cosmético, detergentes, além da fabricação de resinas e aditivos na indústria de alimentos.
- Etano-1,2-diol (Dietilenoglicol) – é um álcool de coloração clara, viscoso, inodoro, de sabor adocicado e tóxico. É muito usado como solvente orgânico, mas também como fluido refrigerante, uma vez que é capaz de fazer decair o ponto de congelamento da água e elevar o ponto de ebulição dela.
Leia também: Funções oxigenadas — compostos que possuem átomos de oxigênio unidos à cadeia carbônica
Exercícios resolvidos sobre álcoois
Questão 1
(UERJ – 1º Exame/2025) Assim como o cortisol, o hormônio adrenalina também é produzido pelas glândulas suprarrenais. Observe as fórmulas estruturais das moléculas correspondentes a esses hormônios:

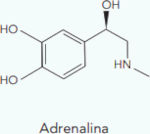
Em ambas as moléculas, observa-se uma mesma função orgânica, que é denominada:
- fenol
- amina
- álcool
- cetona
Resposta: Letra C.
É possível perceber, em ambos os compostos, o radical hidroxila (OH) ligado diretamente a um carbono sp³, configurando a função álcool.
Questão 2
(Urca – 1º Dia/2025.1) O álcool com rápida evaporação e alta pureza é ideal para aplicações que requerem absoluta ausência de umidade. Um exemplo de seu uso é na indústria farmacêutica, na produção de medicamentos e laboratórios, sendo usado como solvente em reações químicas e para limpeza e esterilização de equipamentos.
Sobre a função química álcool é incorreto afirmar:
- O álcool etílico é bastante solúvel em água.
- O etanol quando misturado em determinada concentração com água é um excelente bactericida.
- O etanol pode ser usado como biocombustível.
- O etanol é considerado um combustível renovável.
- O uso do etanol como combustível, apresenta a desvantagem de aumentar o efeito estufa quando comparado ao uso da gasolina.
Resposta: Letra E.
O etanol, apesar de produzir CO2 na sua combustão, não é tão significativo para o efeito estufa quando comparado à gasolina, não só por produzir uma menor quantidade de CO2 na sua combustão, mas também porque vem de uma matriz vegetal que, enquanto nessa forma, retira CO2 do ambiente por fotossíntese.
Fontes:
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.
BARROS, T. D. Glicerol. Embrapa. 8 dez. 2021. Disponível em: <https://www.embrapa.br/agencia-de-informacao-tecnologica/tematicas/agroenergia/p-d-e-i/biodiesel/glicerol>.
G1. Entenda o que é o dietilenoglicol, substância encontrada em cerveja de Belo Horizonte. G1 – Ciência e Saúde. 9 jan. 2020. Disponível em: <https://g1.globo.com/ciencia-e-saude/noticia/2020/01/09/entenda-o-que-e-o-dietilenoglicol-substancia-encontrada-em-cerveja-de-belo-horizonte.ghtml>.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.