As propriedades gerais da matéria são comuns a qualquer tipo de matéria, independentemente de sua composição ou estado físico. Essas propriedades descrevem aspectos básicos e universais, essenciais para o entendimento inicial de fenômenos naturais e processos físicos. Em vista disso, elas não diferenciam substâncias específicas, mas fornecem uma base para identificar como a matéria ocupa espaço, interage e responde a estímulos externos, sendo de extrema importância no estudo da Química e da Física.
Leia também: Afinal, o que é um átomo?
Tópicos deste artigo
- 1 - Resumo sobre as propriedades gerais da matéria
- 2 - Quais são as propriedades gerais da matéria?
- 3 - Propriedades gerais x propriedades específicas da matéria
- 4 - Estados físicos da matéria
- 5 - Exercícios resolvidos sobre propriedades gerais da matéria
Resumo sobre as propriedades gerais da matéria
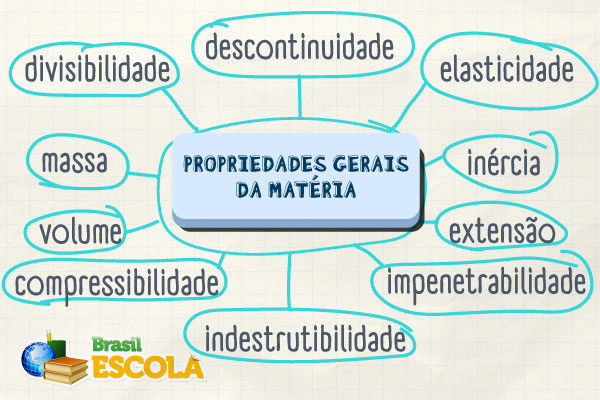
- Propriedades gerais da matéria são características comuns a todos os corpos materiais.
- São propriedades gerais da matéria: massa, extensão, inércia, impenetrabilidade, divisibilidade, compressibilidade, elasticidade, indestrutibilidade, descontinuidade.
- Não distinguem substâncias, pois são universais e independem da composição química.
- Já as propriedades específicas são características exclusivas que permitem identificar substâncias, como densidade, ponto de fusão e ebulição.
Quais são as propriedades gerais da matéria?
As propriedades gerais da matéria são aquelas presentes em qualquer tipo de matéria, independentemente de sua composição ou estado físico, e que são fundamentais para entender os comportamentos e características dos corpos materiais. A seguir, vamos conhecer um pouco sobre cada uma delas:
- Massa: refere-se à quantidade de matéria presente em um corpo. É uma propriedade invariável, ou seja, não depende do local onde o objeto está. Por exemplo, a massa de uma maçã é a mesma na Terra ou na Lua, embora o peso varie devido à gravidade.
- Extensão: diz respeito ao espaço que a matéria ocupa. Porquanto todos os corpos possuem volume, um exemplo seria a água ocupando o espaço interno de uma garrafa.
- Inércia: é a tendência natural da matéria de permanecer em seu estado de repouso ou de movimento, a menos que uma força externa atue sobre ela. Por exemplo, ao frear bruscamente um carro, os passageiros tendem a continuar em movimento, demonstrando essa propriedade.
- Impenetrabilidade: significa que dois corpos não podem ocupar o mesmo espaço ao mesmo tempo. Por exemplo, ao mergulhar uma pedra em um copo cheio de água, o líquido transborda, pois o espaço que a pedra ocupa não pode ser compartilhado pela água.
- Divisibilidade: a matéria pode ser dividida em partes menores sem perder suas propriedades essenciais. Por exemplo, uma barra de chocolate pode ser quebrada em pedaços menores, que ainda são chocolate.
- Compressibilidade: é a capacidade da matéria de reduzir seu volume quando submetida a pressão. Um exemplo é o gás em um balão, que pode ser comprimido ao apertá-lo.
- Elasticidade: representa a capacidade de um corpo de retornar à sua forma original após ser deformado. Por exemplo, ao esticar um elástico e soltá-lo, ele volta ao seu estado inicial.
- Indestrutibilidade: a matéria não pode ser destruída, apenas transformada. Isso está de acordo com a lei da conservação da massa. Por exemplo, ao queimar madeira, os produtos da combustão (gás carbônico, vapor de água e cinzas) representam transformações da matéria inicial.
- Descontinuidade: embora pareça contínua, a matéria é formada por partículas separadas, como átomos e moléculas. Por exemplo, o ar, mesmo sendo invisível, é composto por moléculas que ocupam espaços discretos.
Propriedades gerais x propriedades específicas da matéria
As propriedades gerais e as propriedades específicas da matéria diferenciam-se em sua abrangência e capacidade de distinguir os diferentes tipos de materiais. Essas diferenças podem ser compreendidas conforme as características de cada tipo de propriedade:
- Propriedades gerais: as propriedades gerais são comuns a todos os tipos de matéria, independentemente de sua composição ou estado físico. Elas não permitem distinguir um material de outro, pois estão presentes em qualquer corpo material, como, por exemplo:
- massa;
- extensão;
- inércia;
- impenetrabilidade.
- Propriedades específicas: por outro lado, as propriedades específicas são características únicas que variam de um material para outro. Elas permitem distinguir e identificar substâncias ou materiais. Podem ser divididas em diferentes categorias: físicas, químicas e organolépticas. Vejamos a seguir um pouco sobre cada uma delas.
- Propriedades físicas: estão relacionadas aos aspectos observáveis e medíveis, sem alterar a composição da matéria. Exemplos:
- Densidade: é a relação entre a massa e o volume de uma substância; por exemplo, a água tem densidade de 1 g/cm3 enquanto o ferro tem 7,8 g/cm3.
- Ponto de fusão: temperatura na qual substância passa do estado sólido para o líquido.
- Ponto de ebulição: temperaturas em que a substância muda do estado líquido para o gasoso. Por exemplo, a água ferve a 100 °C, já o álcool a 78 °C.
- Dureza: resistência de um material ao risco (o diamante é o material mais duro conhecido).
- Propriedades químicas: relacionam-se ao comportamento da matéria em transformações químicas, como:
-
- Reatividade: capacidade de reagir com outras substâncias. Por exemplo, o sódio reage violentamente com água.
- Combustibilidade: aptidão para queimar na presença de oxigênio. Exemplo: papel e gasolina são combustíveis, enquanto a água não é.
- Propriedades organolépticas: são características percebidas pelos sentidos humanos:
- Cor, sabor, odor e textura (exemplo: o açúcar é doce e cristalino, enquanto o sal é salgado e granulado).
Estados físicos da matéria
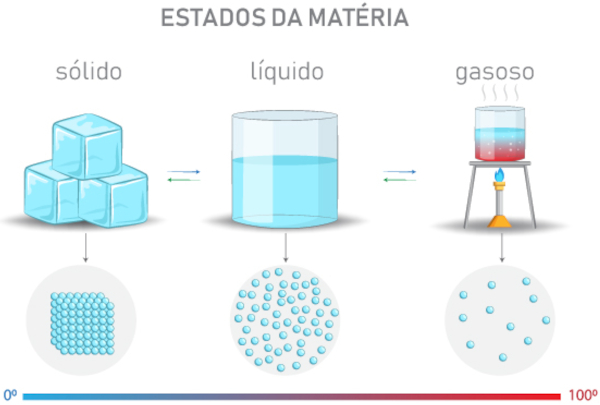
A matéria pode existir em diferentes estados físicos, que são formas distintas de organização das partículas (átomos ou moléculas) que a compõem. Esses estados dependem das condições de temperatura e pressão, que influenciam na energia das partículas. Sendo assim, os três estados mais conhecidos são:
- Sólido: nesse estado, as partículas estão fortemente unidas, com pouca liberdade de movimento, formando uma estrutura organizada. Por isso, os sólidos possuem forma e volume definidos, como é o caso de um pedaço de gelo.
- Líquido: aqui, as partículas estão mais afastadas e possuem maior liberdade de movimento, embora ainda se mantenham próximas. O líquido não tem forma definida, assumindo a forma do recipiente, mas mantém o volume constante. Exemplo: a água em um copo.
- Gasoso: as partículas estão muito afastadas e possuem alta energia, movimentando-se livremente. Por isso, os gases não têm forma nem volume definidos, ocupando todo o espaço disponível no recipiente. Por exemplo: vapor d'água em uma panela.
-
Mudanças de estados físicos da matéria
A matéria pode mudar de um estado para outro ao ganhar ou perder energia, geralmente na forma de calor. Essas mudanças são classificadas conforme o processo:
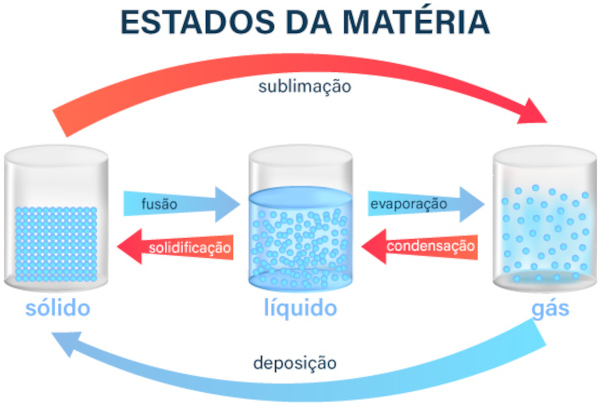
- Fusão: passagem do estado sólido para o líquido ao absorver calor.
- Solidificação: transformação do líquido em sólido ao perder calor.
- Vaporização: mudança do líquido para o gasoso, podendo ocorrer de três formas:
- Evaporação: lenta e natural, como a água secando ao sol.
- Ebulição: rápida, com formação de bolhas, como a água fervendo.
- Calefação: instantânea, ao entrar em contato com uma superfície muito quente.
- Condensação ou liquefação: passagem do gás para o líquido ao perder calor. Exemplo: gotículas de água se formando em um copo gelado.
- Sublimação: transição direta do sólido para o gasoso, sem passar pelo líquido. Um exemplo clássico é a naftalina evaporando.
- Ressublimação ou deposição: mudança direta do gás para o sólido, como, por exemplo, a formação de geada em noites frias.
Exercícios resolvidos sobre propriedades gerais da matéria
1) (PUC) Durante a organização de um laboratório, um aluno percebeu que uma substância sólida e incolor estava armazenada em um recipiente sem identificação. Para tentar identificar qual substância era aquela, o aluno determinou quatro propriedades da matéria:
I. Densidade
II. Massa
III. Temperatura de fusão
IV. Volume
Dentre as propriedades, quais são as que melhor orientariam o aluno na identificação dessa substância?
a) I e II
b) II e IV
c) I e III
d) III e IV
Gabarito: c
As substâncias, de modo geral, podem ser identificadas a partir das propriedades específicas da matéria. Posto isso, dentre as quatro propriedades citadas na questão, apenas duas são específicas: densidade e temperatura de fusão.
2) Quando uma substância é sintetizada em laboratório ou extraída de alguma fonte natural, os químicos separam, purificam e determinam suas propriedades. Se elas coincidem completamente com as de alguma substância já conhecida, então não se tratará de uma nova substância. Se, no entanto, não houver substância conhecida com essas propriedades, terá sido descoberta uma nova substância. De acordo com essas informações, dentre as características de uma substância pura, é correto destacar
a) a densidade constante que independe do seu estado físico.
b) a temperatura de ebulição e de fusão, que são constantes a determinada pressão.
c) as substâncias compostas puras, que não se decompõem em substâncias simples.
d) a ausência de odor, a existência de limpidez e de transparência, que são essenciais à pureza.
e) a variação do coeficiente de solubilidade em relação a determinado solvente, que ocorre à temperatura constante.
Gabarito: b
Substâncias puras possuem características específicas e constantes que ajudam na sua identificação, como a densidade, o ponto de fusão e o ponto de ebulição. Além disso, esses valores são fixos em condições padronizadas de temperatura e pressão (normalmente, 1 atm). Dessa forma, essas propriedades permitem distinguir uma substância pura de misturas, que apresentam variações nessas características.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. A matéria e a energia. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 5–15.
FELTRE, R. et al. Explicando a matéria e suas transformações. In: Quimica Geral. 7. ed. São Paulo: Moderna, 2008. p. 74–103.
L. BROWN, T. et al. Introdução: matéria e medidas. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 1–41.