Kevlar (ou poliarilamida ou poliaramida) é uma fibra sintética ou tecido sintético (polímero) que foi construído pela primeira vez no ano de 1965 pelo cientista Stephanie Kwolek, da empresa norte-americana Du Pont. Essa empresa existe há mais de 200 anos e traz inovação por meio de diversos produtos de usos diversos. O Kevlar, portanto, é uma marca da Dupont e, por isso, apenas ela o fabrica.
Trata-se de um material sintético que apresenta uma resistência em torno de cinco a sete vezes maior que a do aço. Além de ser muito resistente, ele também é muito leve e maleável, o que favorece a sua aplicação em peças de uso pessoal, como um colete à prova de balas. Seu lançamento no mercado só ocorreu no ano de 1982.
Abaixo vamos conhecer a forma de obtenção, características e utilizações do Kevlar:
a) Obtenção
O Kevlar é obtido a partir de uma reação orgânica de polimerização (formação de uma grande estrutura a partir de moléculas menores) por condensação, ou seja, para ser formado, é necessária a liberação de molécula de água e consequente união de várias moléculas dos compostos envolvidos.
A produção do Kevlar é feita por meio de um ácido carboxílico (p-benzenodioico) e de uma amina (benzenodiamina). O ácido p-benzenodioico possui em sua estrutura química duas carboxilas, uma no carbono 1 e outra no carbono quatro do benzeno. Nesses grupos, temos a presença de hidroxila.
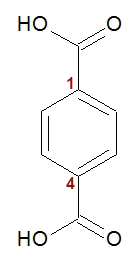
Fórmula estrutural do ácido p-benzenodioico
A benzenodiamina, por sua vez, possui em sua estrutura dois grupos amina localizados nos carbonos 1 e 4 do benzeno. Cada grupo amino possui dois átomos de hidrogênio.
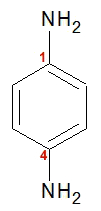
Fórmula estrutural da benzenodiamina
A partir da união entre o grupo hidroxila de uma das carboxilas do ácido p-benzenodioico e o hidrogênio de um dos grupos amino da p-benzenodiamina, temos a formação de uma molécula de água (por isso chamamos a reação de condensação ou eliminação), como demonstrado abaixo:
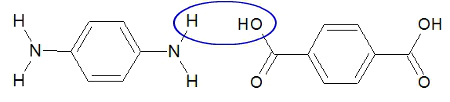
Água formada a partir do ácido p-benzenodioico e benzenodiamina
Como temos várias moléculas do ácido p-benzenodioico e da p-benzenodiamina no meio, cada molécula do ácido é capaz de interagir com duas moléculas da amina e vice-versa. Isso ocorre porque o ácido apresenta duas hidroxilas e a amina possui dois grupos amino. Assim, um das hidroxilas (OH) de um ácido interage com um dos hidrogênios de uma amina e assim sucessivamente:
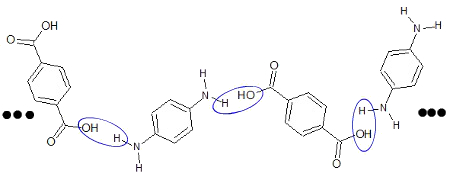
Formação de moléculas de água a partir de várias moléculas do ácido p-benzenodioico e benzenodiamina
OBS.: Os três pontos pretos à direita e à esquerda da figura acima apenas servem para indicar a presença de outras estruturas.
Além da formação das moléculas de água a partir do ácido p-benzenodioico e da benzenodiamina, o carbono (seta azul) da carboxila que perdeu o grupo hidroxila na formação da água liga-se diretamente com o nitrogênio (seta vermelha) do grupo amino que perdeu um átomo de hidrogênio, formando um monômero (unidade ou parte fundamental do polímero Kevlar, que está entre os colchetes na imagem abaixo).
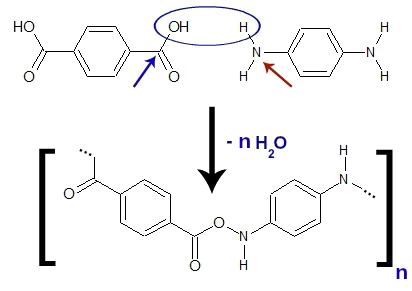
Equação geral de formação do Kevlar
OBS.: As reticências localizadas à esquerda e à direita na imagem acima indicam que outras estruturas do ácido e da amina estão ligadas.
Como observado acima, cada monômero do Kevlar apresenta uma parte do ácido p-benzenodioico e outra da benzenodiamina. A parte do ácido à esquerda une-se à outra parte da amina, e a da amina une-se à outra parte do ácido e assim sucessivamente, formando o polímero.
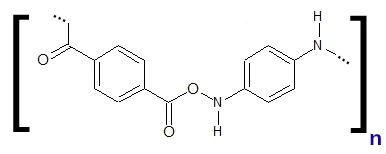
Fórmula estrutural do monômero do Kevlar
b) Caraterísticas
-
Resistente ao fogo (apenas sofre combustão em temperaturas superiores a 1000 OC);
-
Resistente a ataque químico (contato com ácidos fortes, por exemplo);
-
Resistente a impacto mecânico (um tiro de arma de fogo, por exemplo).
c) Utilizações

Roupa protetora feita com Kevlar
-
Produção de peças de aviões
-
Fabricação de roupas de pilotos de fórmula 1
-
Presente em coletes à prova de bala
-
Chassi de carros de corrida;
-
Tanque de combustível de carros de corrida;
-
Capa física de alguns smartphones;
-
Fabricação de cintos de segurança;
-
Fabricação de cordas;
-
Fabricação de linhas de pesca;
-
Presente na composição de alguns pneus.
Por Me. Diogo Lopes Dias
