O európio é um elemento químico pertencente à série dos lantanídeos, com símbolo “Eu” e número atômico 63, conhecido por suas propriedades luminescentes, pois emite uma luz vermelha brilhante quando excitado por radiação ultravioleta, o que o torna essencial em tecnologias de iluminação e exibição, como televisores, monitores e LEDs. Descoberto pelo químico francês Demarçay em 1901, esse metal tem um papel significativo na indústria moderna devido à sua capacidade de absorver nêutrons, sendo utilizado em barras de controle de reatores nucleares.
Além de suas aplicações tecnológicas, o európio é um elemento reativo, oxidando rapidamente ao ar e reagindo com água para formar hidróxidos. Ademais, é encontrado principalmente em minerais de terras raras, como monazita e bastnaesita, e extraído através de processos complexos de separação e purificação. Em vista disso, apesar de ser relativamente raro, ele é um elemento indispensável em diversos segmentos, contribuindo significativamente para avanços na eletrônica, iluminação e segurança nuclear.
Leia também: Lantânio — outro lantanídeo da tabela periódica
Tópicos deste artigo
- 1 - Resumo sobre o európio
- 2 - Propriedades do európio
- 3 - Características do európio
- 4 - Onde o európio é encontrado?
- 5 - Ocorrência do európio
- 6 - Obtenção do európio
- 7 - Aplicações do európio
- 8 - Precauções com o európio
- 9 - História do európio
- 10 - Curiosidades sobre o európio
Resumo sobre o európio
-
O európio é um metal da série dos lantanídeos (terras raras) de aparência prateada metálica.
-
É sólido à temperatura ambiente e exibe propriedades magnéticas a temperaturas baixas.
-
Apresenta propriedades luminescentes, emitindo luz vermelha sob radiação UV.
-
É reativo, oxida rapidamente no ar e reage com água.
-
Pouco solúvel em água e solventes comuns, mas é solúvel em ácidos fortes.
-
Relativamente raro, é encontrado em minerais como monazita e bastnaesita.
-
Pode ser utilizado em fósforos para televisores, LEDs e lâmpadas fluorescentes.
-
É importante em barras de controle de reatores nucleares.
-
Empregado em tintas de segurança para cédulas de dinheiro.
-
Sua produção envolve processos que vão desde a extração até a purificação.
-
Foi descoberto por Eugène-Anatole Demarçay em 1901 e nomeado em homenagem ao continente europeu.
Propriedades do európio
-
Símbolo: Eu.
-
Massa atômica: 151,96 u.
-
Número atômico: 63.
-
Configuração eletrônica: 4f7 6s2.
-
Eletronegatividade: 1,20 (na escala Pauling).
-
Eletroafinidade: -50 kJ/mol.
-
Série química: lantanídeos (terras raras).
-
Ponto de fusão: 826°C.
-
Ponto de ebulição: 1529°C.
-
Energia de ionização: 547,1 kJ/mol (primeira ionização).
-
Densidade: 5,24 g/cm³ (no estado sólido).
-
Estado de oxidação: +2 e +3.
-
Raio atômico (Van der Waals): 233 pm.
Características do európio
O európio possui características interessantes em relação à sua natureza metálica. Por exemplo, quando está em sua forma pura, não possui uma cor típica de metal, sendo naturalmente amarelo pálido em sua aparência metálica, conforme é mostrado a seguir.

No entanto, em suas formas mais comuns, como em compostos, ele exibe cores variadas devido às suas propriedades luminescentes, podendo emitir uma luz vermelha intensa quando estimulado por radiação ultravioleta conforme a imagem abaixo.
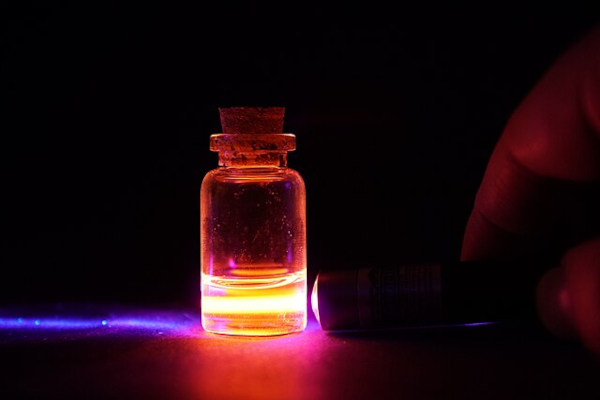
Além disso, o európio é altamente reativo, oxidando rapidamente ao ser exposto ao ar e reagindo vigorosamente com a água para formar hidróxidos. Já em relação à solubilidade, ele é considerado pouco solúvel em água e em solventes comuns, especialmente em sua forma metálica, que é particularmente insolúvel em água, mas pode reagir com ácidos fortes para formar sais solúveis. Por outro lado, alguns de seus compostos podem ser solúveis em certos ácidos e solventes orgânicos.
Onde o európio é encontrado?
O európio é encontrado principalmente em minerais como a monazita, que é um fosfato complexo que contém várias terras raras, e a bastnaesita, um fluocarbonato de lantanídeos, ambos espalhados em depósitos por vários países como China, Estados Unidos, Índia e Brasil. Nesse sentido, também podemos citar a xenotima, um fosfato de terras raras que ocorre em pegmatitos e depósitos aluviais, com extrações significativas na Malásia e na Indonésia. Ademais, é encontrado na euxenita, um óxido complexo encontrado em pegmatitos, principalmente na Noruega e Madagascar. E, por fim, na gadolinite, silicato de terras raras encontrado em pegmatitos, principalmente na Suécia e nos Estados Unidos.
Ocorrência do európio
O európio ocorre naturalmente em seus compostos, podendo variar em formas e contextos, sobretudo na forma de minerais, os quais são suas principais fontes de obtenção. Diante disso, para cada uma das formas de minério abaixo, ele pode ser encontrado substituindo quaisquer dos elementos dentro dos parênteses.
-
Monazita: (Ce,La,Th,Nd,Y)PO₄
-
Bastnaesita: (Ce,La,Y)CO3F
-
Xenotima: YPO4
-
Euxenita: (Y, Ca, Ce, U, Th)(Nb, Ta, Ti)2O6
-
Gadolinite: (Ce,La,Nd,Y)2FeBe2Si2O10
Além de sua ocorrência em minerais, pequenas quantidades desse metal podem ser encontradas em alguns meteoritos, o que sugere que ele está presente em outras partes do sistema solar. No entanto, a sua principal fonte para usos comerciais e industriais vem da mineração e processamento dos minerais mencionados.
Obtenção do európio
A obtenção do európio começa basicamente com a mineração de minerais ricos em terras raras, como a monazita e a bastnaesita, para em seguida passar pelos demais procedimentos de extração. Nesse contexto, destacamos a seguir as principais etapas envolvidas nesse processo:
-
Trituração e tratamento: nessa etapa, subsequente à extração, é feita a trituração dos minerais e tratamento com ácidos para dissolver os componentes solúveis.
-
Separação: em seguida, é feita a utilização de processos químicos, como extração por solvente e troca iônica, para separar os diferentes lantanídeos, incluindo o európio. Esses métodos aproveitam as pequenas diferenças nas propriedades químicas dos elementos para isolá-los uns dos outros.
-
Conversão: o európio separado é geralmente convertido em óxido de európio (Eu2O3).
-
Redução: o európio metálico é obtido por redução com cálcio em um processo de alta temperatura, realizado em um ambiente controlado para evitar a sua oxidação, por ser altamente reativo.
-
Purificação: o metal obtido é purificado para remover impurezas e obter európio de alta pureza.
Aplicações do európio
O európio tem diversas aplicações, especialmente em áreas como tecnologia em produtos de alta precisão. Sendo assim, para que possa ter uma ideia de sua utilidade, a seguir destacamos alguns dos seus principais usos.
-
É amplamente utilizado em fósforos que emitem luz vermelha em televisores, telas de computador e dispositivos móveis, bem como em LEDs, sendo um componente essencial nas telas de plasma e LCD.
-
Em lâmpadas fluorescentes, compostos de európio são usados para converter a luz ultravioleta em luz visível, melhorando a eficiência e a qualidade da iluminação.
-
Devido à sua capacidade de absorver nêutrons, ele é usado em barras de controle em reatores nucleares, ajudando a controlar o processo de fissão nuclear.
-
É utilizado em detectores de radiação, em que seus compostos ajudam a medir a intensidade e a presença de radiação ionizante.
-
É utilizado em tintas especiais para cédulas de dinheiro e outros documentos importantes, ajudando a prevenir falsificações devido às suas propriedades luminescentes.
-
É empregado em várias áreas da pesquisa científica, incluindo química analítica e espectroscopia, devido às suas propriedades de luminescência e absorção.
Veja também: Itérbio — um lantanídeo que ainda possui poucas aplicações
Precauções com o európio
Embora o európio não seja altamente tóxico, algumas precauções são necessárias ao manuseá-lo, especialmente em sua forma metálica ou em compostos solúveis. Sendo assim, temos alguns pontos importantes a considerar.
Primeiramente, o európio metálico é bastante reativo, oxidando facilmente ao ar e reagindo com água para formar hidróxidos. Portanto, deve ser armazenado em ambientes inertes, como em óleo mineral ou em atmosferas de gás inerte, para evitar reações indesejadas.
Além disso, os compostos de európio devem ser manuseados com cuidado para evitar inalação, ingestão ou contato prolongado com a pele. Nesse caso, usar equipamentos de proteção individual (EPI), como luvas, óculos de proteção e máscaras, é recomendado durante o manuseio de compostos químicos desse elemento, especialmente em laboratórios e indústrias.
Outro ponto importante é a disposição adequada dos resíduos que o contêm, seguindo regulamentos ambientais e diretrizes de descarte de materiais perigosos, para evitar contaminação do meio ambiente.
Por fim, vale dizer que garantir uma ventilação adequada nos locais de trabalho e seguir procedimentos de segurança específicos para substâncias químicas reativas são medidas essenciais para minimizar riscos associados ao manuseio de európio e seus compostos.
História do európio
A história do európio tem como ponto de partida o final do século XIX, mais precisamente 1901, ano em que foi descoberto pelo químico francês Eugène-Anatole Demarçay. Contudo, antes desse feito, os minerais contendo európio já eram conhecidos, mas não era possível distingui-lo dos outros elementos das terras raras devido à sua semelhança química. Para isso, Demarçay, um especialista em espectroscopia, utilizou técnicas avançadas para analisar as linhas espectrais desses minerais e identificou um espectro novo, que ele atribuiu a um novo elemento, o európio.
Inicialmente, a obtenção de európio puro era bastante difícil devido à sua presença em pequenas quantidades nos minerais e à dificuldade de separá-lo de outros lantanídeos. Mas, com o tempo, métodos mais eficientes de extração e separação foram desenvolvidos, permitindo o seu isolamento em quantidades maiores e de maior pureza. Por fim, a descoberta desse metal e seu desenvolvimento subsequente exemplificam como avanços em técnicas analíticas e de separação podem levar à identificação de novos elementos e à criação de novas tecnologias.
Curiosidades sobre o európio
-
O nome "európio" foi dado em homenagem ao continente europeu, sendo um dos poucos elementos químicos que levam o nome de um continente.
-
Foi descoberto relativamente tarde, em 1901, pelo químico francês Eugène-Anatole Demarçay, comparado a muitos outros elementos que foram identificados no século XIX.
-
É um dos poucos elementos que apresenta magnetismo a temperaturas muito baixas, o que o torna útil em estudos de propriedades magnéticas em materiais.
-
É um dos poucos lantanídeos que pode estabilizar o estado de oxidação +2 em soluções aquosas, além do mais comum +3. Isso fez dele objeto de estudo interessante na química de coordenação.
Créditos de imagem
Alchemist-hp / Wikimedia Commons (reprodução)
Maxim Bilovitskiy / Wikimedia Commons (reprodução)
Fontes
BANDA, R. et al. Yttrium and europium separation by solvent extraction with undiluted thiocyanate ionic liquids. RSC Advances, [s. l.], v. 9, n. 9, p. 4876–4883, 2019. Disponível em: https://xlink.rsc.org/?DOI=C8RA09797F.
BÜNZLI, J.-C. Europium in the limelight. Nature Chemistry, [s. l.], v. 2, n. 8, p. 696–696, 2010. Disponível em: https://www.nature.com/articles/nchem.760.
CABELLO, G.; LILLO, L.; CARO, C. EUROPIUM: COMPOUNDS, PRODUCTION AND THEIR OPTICAL APPLICATIONS. In: CHEMISTRY RESEARCH SUMMARIES: VOLUME 2. [S. l.: s. n.], 2012. v. 2, p. 151.
DAI, Y. et al. Homogeneous liquid–liquid extraction of europium from aqueous solution with ionic liquids. Journal of Radioanalytical and Nuclear Chemistry, [s. l.], v. 319, n. 3, p. 1219–1225, 2019. Disponível em: http://link.springer.com/10.1007/s10967-019-06419-7.
Europium | Eu (Element) - PubChem. Disponível em: https://pubchem.ncbi.nlm.nih.gov/element/63.
GRAHAM, A. L.; RINGWOOD, A. E. Lunar basalt genesis: the origin of the europium anomaly. Earth and Planetary Science Letters, [s. l.], v. 13, n. 1, p. 105–115, 1971. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/0012821X71901117.
LOSS, R. D.; CORISH, J. Names and symbols of the elements with atomic numbers 114 and 116 (IUPAC recommendations 2012). Pure and Applied Chemistry, [s. l.], v. 84, n. 7, p. 1669–1672, 2012. Disponível em: https://www.degruyter.com/document/doi/10.1351/PAC-REC-11-12-03/html.
PÖTTGEN, R.; JOHRENDT, D. Equiatomic Intermetallic Europium Compounds: Syntheses, Crystal Chemistry, Chemical Bonding, and Physical Properties. Chemistry of Materials, [s. l.], v. 12, n. 4, p. 875–897, 2000. Disponível em: https://pubs.acs.org/doi/10.1021/cm991183v.
WELLER, M. et al. A química dos lantanídeos. In: QUÍMICA INORGÂNICA. 6. ed. Porto Alegre: Bookman, 2017. p. 628–642.
XU, H. et al. Electroluminescence from europium(III) complexes. Coordination Chemistry Reviews, [s. l.], v. 293–294, p. 228–249, 2015. Disponível em: https://linkinghub.elsevier.com/retrieve/pii/S0010854515000843.

